
用a mol H2与b mol Cl2合成HCl,再将反应后的气体通入足量的NaOH溶液中充分吸收,按要求填写下表(可不填满):
| a和b大小关系 | 通过NaOH溶液后是否有气体剩余及其质量 | 生成NaCl物质的量 |
①a=b 无 2a或2b mol
②a>b 2(a-b) mol H2 2b mol
③a<b 无 (a+b) mol
27.在250 mL KI溶液中通入一定量的Cl2,再将所得溶液蒸干,并加热到质量不再减少为止,称得固体质量为23.2 g,经实验分析所得固体中含碘27.32%,试计算:
(1)原KI溶液的物质的量浓度。
(2)参加反应的Cl2有多少升(标准状况)?
(1)c(KI)=1 mol·L-1
(2)V(Cl2)=2.24 L
(1)23.2 g固体为KCl与KI,含碘为27.32%,则含KI为
27.32%×![]() =35.7%
=35.7%
则m(KCl)=23.2 g×64.3%=14.9 g
参加反应的KI的物质的量为:
2KI + Cl2 ====2KCl+I2
2 mol 1mol 149 g
n′(KI)=0.2 mol 14.9 g
参加反应的Cl2为0.1 mol,标准状况下的体积为2.24 L
23.2 g固体中所含KI的质量为
23.2 g-14.9 g=8.3 g即0.05 mol
原KI溶液中的KI的物质的量浓度为:
c(KI)=![]() =1 mol·L-1
=1 mol·L-1
(2)参加反应的Cl2在标准状况下的体积为2.24 L。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
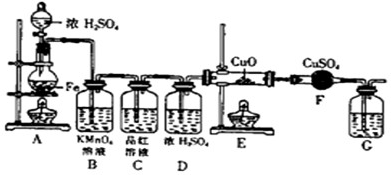
查看答案和解析>>
科目:高中化学 来源: 题型:
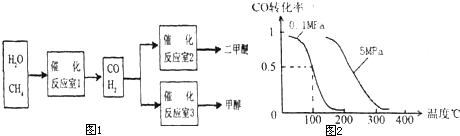
查看答案和解析>>
科目:高中化学 来源: 题型:
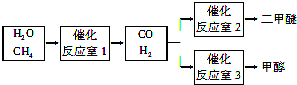
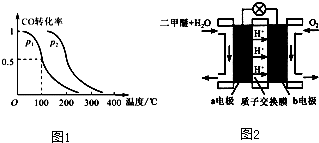
查看答案和解析>>
科目:高中化学 来源: 题型:
a和b大小关系 | 通过NaOH溶液后是否有气体剩余及其质量 | 生成NaCl物质的量 |
|
|
|
|
|
|
|
|
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com