
分析 根据n=$\frac{m}{M}$分别计算出HCl、NaCN的物质的量,然后计算出生成HCN的物质的量,再根据c=$\frac{n}{V}$计算出HCN浓度,设混合液中H3O+的浓度为x,则c(H3O+)≈c(CN-)=x,HCN的浓度为0.5-x,结合电离平衡常数的表达式列式计算.
解答 解:5.01g HCl的物质的量为:$\frac{5.01g}{36.46g/mol}$=0.1375mol,6.74gNaCN的物质的量为:$\frac{6.74g}{49.01g}$=0.1375mol,
两溶液恰好反应生成0.1375molHCN,反应后HCN的浓度为:$\frac{0.1375mol}{0.275L}$=0.5mol/L,
设混合液中H3O+的浓度为x,则c(H3O+)≈c(CN-)=x,HCN的浓度为0.5-x,
根据HCN的平衡常数可知:K=$\frac{x×x}{0.5-x}$=4×10-10,解得:x≈1.414×10-5mol/L,
则H3O+,CN-的浓度分别为1.414×10-5mol/L、1.414×10-5mol/L,HCN的浓度约为0.500mol/L,
答:H3O+,CN-、HCN的浓度分别为1.414×10-5mol/L;1.414×10-5mol/L;0.500mol/L.
点评 本题考查了电离平衡常数的计算,题目难度中等,明确电离平衡常数的概念及表达式为解答关键,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液的碱性增强 | |
| B. | 阳极反应:CO32--2e-+H2O═CO2↑+2OH- | |
| C. | 溶液中CO32-+H2O?HCO3-+OH-平衡不移动 | |
| D. | 向溶液中加入一定量HCOOH的能复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
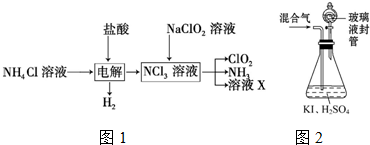
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
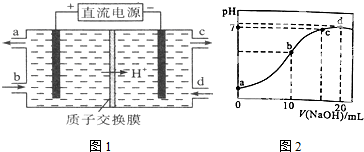
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4难溶于水,但BaSO4是电解质 | |
| B. | 铜和石墨均能导电,所以它们都是电解质 | |
| C. | 电解质一定能导电,能导电的物质不一定属于电解质 | |
| D. | 液态HCl不导电,所以HCl不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| B. | △H1=+178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| D. | △H1=+178.32kJ•mol-1△H2=+78.3kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com