
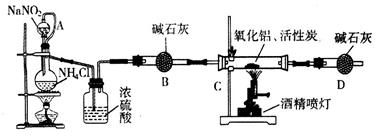
 。
。 NaCl+N2↑+2H2O(2分) (2)c(2分)
NaCl+N2↑+2H2O(2分) (2)c(2分) NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。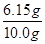 ×100%=61.5%。
×100%=61.5%。

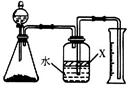
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
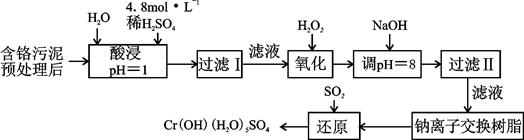
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)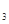 的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。查看答案和解析>>
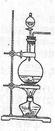
科目:高中化学 来源:不详 题型:实验题
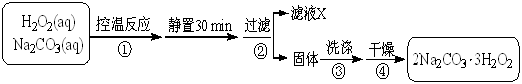
 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
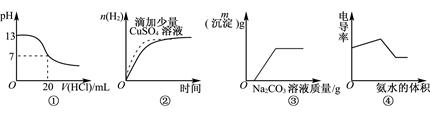
| A.图①表示25℃时,0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向盐酸和醋酸混合溶液中滴入氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.980 ml ,114.7g | B.500ml, 58.5g |
| C.1000 ml, 117 g | D.1000ml, 117.0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com