
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有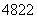 Ti和
Ti和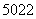 Ti两种原子,它们互称为______________。Ti元素基态原子的电子排布式为________________________。
Ti两种原子,它们互称为______________。Ti元素基态原子的电子排布式为________________________。
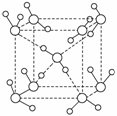
(2)如图是偏钛酸钡晶体的晶胞结构,可推知它的化学式为____________(用元素符号表示)。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
继2008年5月12日,我国汶川发生大地震。全国人民“众志成城,抗震救灾”,青海又发生了玉树大地震,在自然灾害面前,党和政府提出的口号是:
(1)“拯救生命是第一位的”。为搜救埋在废墟下的幸存者,调用了许多搜救犬。搜救犬能根据人体发出的气味发现幸存者。从微观的角度分析搜救犬能发现幸存者的原因是________。
A.分子的质量很小 B.不同分子性质不同
C.分子不断运动 D.分子间有间隔
(2)地震中许多原有的水源被破坏。新水源需检测和处理后才能成为饮用水。我国规定水质必须在感官指标、化学指标、细菌学指标等方面均达标方可成为生活饮用水。
①感官指标中有一项要求:不得含有肉眼可见物,水应澄清透明。为达到此要求,净化水时,可以通过加入絮凝剂凝聚、沉降,然后通过__________(填操作名称)而实现。
②化学指标中含有水源的pH和硬度两项。
测定液体pH的方法是______________________________________。
日常生活中如何区分硬水与软水?请简述实验步骤与现象:
____________________________________________________________。
③细菌学指标中对细菌的含量有严格的限制。要杀灭细菌可以向水中加入________等消毒剂,也可以通过________操作,既杀灭细菌,又能得到几乎纯净的水。
(3)为防止灾后疫情的发生,某医疗小分队用溶质质量分数为0.5%的过氧乙酸溶液对灾民的居住环境进行消毒。要配制溶质质量分数为0.5%的过氧乙酸溶液300 kg,需溶质质量分数为15%的过氧乙酸________kg,配制的主要步骤是__________、________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某些化学试剂经毒理学证明对人体有害,下列物质中严禁作为食品添加剂使用的是 ( )。
①硫黄 ②日落黄 ③苯甲酸钠 ④明矾 ⑤过氧化苯甲酰 ⑥水杨酸 ⑦甲醛 ⑧甲醛次硫酸氢钠(吊白块)
A.⑥⑦⑧ B.④⑤⑥⑦⑧
C.①③④⑥⑦⑧ D.①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶胞的叙述,正确的是( )
A.晶胞的结构就是晶体的结构
B.不同的晶体中晶胞的大小和形状都相同
C.晶胞中的任何一个粒子都属于该晶胞
D.已知晶胞的组成就可推知晶体的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)水在不同的温度和压强条件下可以形成11种不同结构的晶体,密度从比水轻的0.92 g·cm-3到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰Ⅶ的晶体结构为一个如下图所示的立方晶胞,每个水分子可与周围__________个水分子以氢键结合,晶体中,1 mol水可形成________mol氢键。
(2)已知下列元素的电负性数据:H为2.1,O为3.5,F为4.0。
OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F—O键中共用电子对偏向F而产生的极性;②从电负性上看,__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.在离子晶体中,一定存在离子键
B.阳离子只有氧化性,阴离子只有还原性
C.纳米粒子分散到水中,有丁达尔现象
D.等离子体是由大量的带电微粒组成的,是继固体、液体、气体之后物质的另一种聚集状态
查看答案和解析>>
科目:高中化学 来源: 题型:
等离子体的用途十分广泛,运用等离子体束切割金属或者进行外科手术,利用了等离子体的特点是( )
A.微粒带有电荷 B.高能量
C.基本构成微粒多样化 D.准电中性
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组在学习CO的化学性质时,准备做CO还原CuO的实验。下面是同学们设计的四套实验装置图。从安全和能源充分利用的角度来看,你认为最理想的实验装置是( )
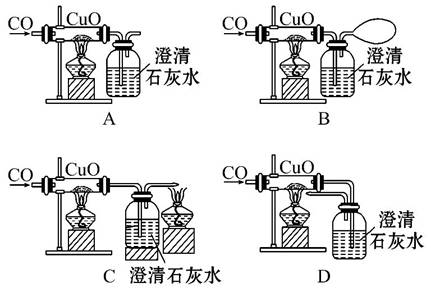
查看答案和解析>>
科目:高中化学 来源: 题型:
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC________Si;SiCl4________SiO2。
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
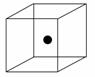
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)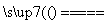 Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH=________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com