
【题目】锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是( )

A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中混有NaOH杂质,则结果偏低。
B. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高锰酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
C. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
D. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在 K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+2H+。有关该平衡的下列说法中正确的是
2CrO42-(黄色)+2H+。有关该平衡的下列说法中正确的是
A. 当化学平衡向逆反应方向移动时,则平衡常数一定减小
B. 当反应速率2v(Cr2O72-)正= v(CrO42-)逆时,则反应一定处于平衡状态
C. 当化学平衡向正反应方向移动时,则溶液的pH一定降低
D. 当向溶液中加入一定量的水时,则化学平衡一定不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素是形成化合物种类最多的元素 |
C元素基态原子的核外p电子数比s电子数少1 |
D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别是: I1=738kJ/mol,I2 = 1451 kJ/mol,I3 = 7733kJ/mol,I4 = 10540kJ/mol |
F元素的主族序数与周期数的差为4 |
G元素是前四周期中电负性最小的元素 |
H元素位于元素周期表中的第八列 |
(1)C2A4的电子式为______________。(A、C为字母代号,请将字母代号用元素符号表示,下同)
(2)B元素的原子核外共有______种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈_______形。
(3)某同学推断E元素基态原子的核外电子排布图为:![]() 。该同学所画的电子排布图违背了________________,该元素的原子I3远远大于I2,其原因是__________________________________。
。该同学所画的电子排布图违背了________________,该元素的原子I3远远大于I2,其原因是__________________________________。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是_______________。(用离子符号表示)
(5)用惰性电极电解EF2的水溶液的离子方程式为_____________________________。
(6)H位于元素周期表中_______区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验H2+时产生蓝色沉淀,该反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
1 | Mg、Al | 稀盐酸 | 偏向Al |
2 | Al、Cu | 稀盐酸 | 偏向Cu |
3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
5 | Al、Zn | 浓硝酸 | 偏向Al |
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)________。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:______________________________。
②石墨为________极,电极反应式:___________________________。
③电池总反应式:______________________________________。
(3)实验4中铝作负极还是正极________,理由是__________________________
写出铝电极的电极反应式_________________________________。
(4)解释实验5中电流计指针偏向铝的原因:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示:

下列说法不正确的是( )
A. 尿素水溶液热分解反应不属于氧化还原反应
B. 转化器工作过程中,当转移0.6mol电子时,会消耗4.48L NH3
C. 该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
D. 转化NO2过程的化学方程式为:8NH3+6NO2![]() 2N2+12H2O
2N2+12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
(1)画出元素⑨阴离子的结构示意图:______,⑧正下方的元素原子序数为____
(2)③⑤⑧的原子半径由小到大的顺序为________(填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为___________(填化学式)。
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为____________________。
(5)用电子式表示⑥和⑨形成的化合物的过程:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g),则下列说法正确的是
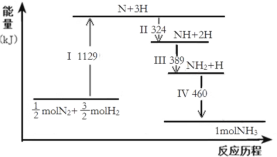
A.Ⅰ中破坏的均为极性键
B.Ⅳ中NH2与H2生成NH3
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g)![]() 2NH3(g)1mol氮气完全反应放热44kJ
2NH3(g)1mol氮气完全反应放热44kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com