
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
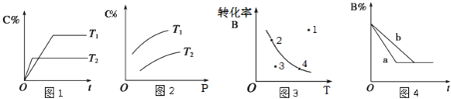
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
【答案】C
【解析】
A.根据图象中“先拐先平,数值大”知,T1<T2,升高温度,C在反应混合物中的体积分数(ф)降低,说明平衡向逆反应方向移动,升高温度向吸热反应方向移动,则正反应方向是放热反应,故A错误;
B.由图2图象可以看出,在同一温度下,增大压强,C在反应混合物中的体积分数(ф)增大,说明增大压强平衡向正反应方向移动,说明正反应为体积缩小的反应,即m+n>p,故B错误;
C.在曲线上,当温度一定时,B的转化率也一定,曲线上任意一点都表示达到平衡状态,所以2、4处于平衡状态,v(正)=v(逆),点1在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,即由点1向下引垂直线到曲线上的一点,这样B的转化率要减小,平衡逆向移动,故v(正)<v(逆),点3在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,即由点3向上引垂直线到曲线上的一点,这样B的转化率要增大,平衡正向移动,故v(正)>v(逆),故C正确;
D.a的时间短,反应速率快,催化剂只改变化学反应速率不影响化学平衡,可能为使用了催化剂,但若m+n=p,说明反应前后气体的物质的量不变,增大压强,正、逆速率都同等程度增大,到达平衡时间短,不影响平衡,所以a曲线也可能是增大压强,故D错误;
故选:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】苯是一种重要的化工原料,下列有关说法正确的是( )。
A.苯可以在空气中燃烧,燃烧时产生明亮并带有浓烟的火焰
B.苯分子中含有碳碳双键,所以可使酸性高锰酸钾溶液褪色
C.苯中加入溴水,振荡后溶液分层,水层无色,说明苯与溴水发生了取代反应
D.苯与氢气催化条件下可发生加成反应,产物环己烷的二氯代物有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]制备需要的CuCl2可用Fe3+作催化剂得到,其催化原理如图所示. 下列有关说法正确的是

A.a、b、c 之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.若制备1 mol的CuCl2,理论上消耗11.2 LO2
D.N参加的反应离子方程式为:4Fe2++ O2+ 4H+ = 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
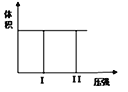
【题目】(I)在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) ![]() 2Z(g), 若把2molX和1molY充入该容器时,处于状态I,反应在绝热条件下达到平衡时处于状态II(如图),则该反应的△H___0;(填:“<,>,=”)。该反应在___(填:高温或低温)条件下能自发进行。
2Z(g), 若把2molX和1molY充入该容器时,处于状态I,反应在绝热条件下达到平衡时处于状态II(如图),则该反应的△H___0;(填:“<,>,=”)。该反应在___(填:高温或低温)条件下能自发进行。
(II)已知2A2(g)+B2(g)![]() 2C(g) △H=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量bkJ。请回答下列问题:
2C(g) △H=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量bkJ。请回答下列问题:
(1)若将反应温度升高到700℃,反应的平衡常数将___(填“增大”、“减小”或“不变”)。
(2)若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系(用代数式表示)___。
(3)能说明该反应已经达到平衡状态的是(_____)
a.V(C)=2V(B2) b.容器内气体压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是(_____)
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达平衡后,放出热量dkJ,则d___b(填>、=、<)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A. 通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和1/2 mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用右图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系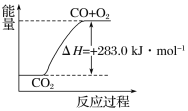
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如下图所示。
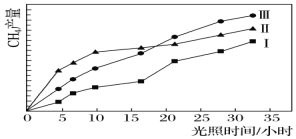
(1)在0~30小时内,CH4的平均生成速率vⅠ、vⅡ、vⅢ从大到小的顺序为__________;反应开始后的12小时内,在第________种催化剂作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ·mol-1。
①在下列坐标图中,画出反应过程中体系能量变化图(进行必要标注)。________;

②将等物质的量的CH4和H2O(g)充入1 L恒容密闭反应器,某温度下反应达平衡,平衡常数K=27,此时测得CO的物质的量为0.10 mol,则CH4的平衡转化率为________(结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1,写出由CO2生成CO的热化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图所示,化合物中除![]() 外其它原子均满足8电子稳定结构。下列说法正确的是
外其它原子均满足8电子稳定结构。下列说法正确的是
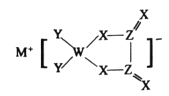
A.M的单质通常保存在煤油中B.W的最高价氧化物对应的水化物是一元弱酸
C.简单气态氢化物稳定性X>YD.上述五种元素中Z的电负性最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯的催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式如下:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正×x(CH3COOCH3) ×x(C6H13OH),v逆=k逆×x(CH3COOC6H13) ×x(CH3OH),其中是k正、k逆为速率常数(受温度影响),x为各组分的物质的量分数。反应开始时,CH3COOCH3和C6H13OH按物质的量之比1:1投料,测得338K、343K、348K三个温度下CH3COOCH3转化率(![]() )随时间(
)随时间(![]() )的变化关系如图所示。下列说法正确的是
)的变化关系如图所示。下列说法正确的是
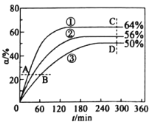
A.该反应的△H>0
B.348K时,该反应的平衡常数为1.8
C.A、B、C、D四点中,v正最大的是D
D.在曲线①、②、③中,k正与k逆的差值最大的曲线是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com