
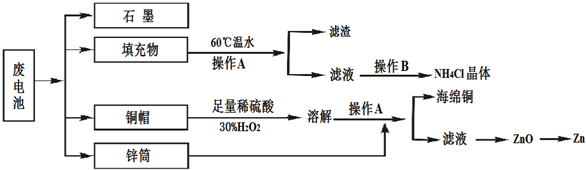
分析 废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌,
(1)加热适当温度,可促进溶解,注意温度不能过高;
(2)操作A用于分离和固体和液体,为过滤操作;
(3)酸性条件下,双氧水能将铜氧化生成铜离子;加热条件下,双氧水易分解;
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
(5)①根据二氧化锰和转移电子之间的关系式计算;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水.
解答 解:废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌,
(1)加热适当温度,可促进溶解,
故答案为:加快溶解速率;
(2)操作A用于分离和固体和液体,为过滤操作,故答案为:过滤;
(3)酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热,
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热;
(4)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OH--2e-=Zn(OH)2,
故答案为:Zn+2OH--2e-=Zn(OH)2;
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2 MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①反应中,氧化剂是MnO(OH)、MnO2,还原剂是草酸,当1mol MnO2参加反应时,转移电子的物质的量=$\frac{1mol}{1}$×2×2×(4-3)=4mol,
故答案为:4;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水,反应方程式为2MnO(OH)+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+Cl2↑+4H2O,
故答案为:2MnO(OH)+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+Cl2↑+4H2O.
点评 本题考查了物质的分离和提纯、原电池原理,根据原电池正负极上发生的反应、物质的性质及其分离方法来分析解答,能从整体上把握物质分离过程,熟练掌握基础知识,灵活运用知识解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
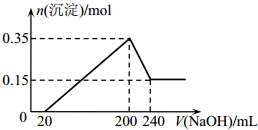 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )| A. | 生成的氢气在标准状况下的体积为11.2L | |
| B. | 最初20mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为2.5mol/L | |
| D. | 镁和铝的总质量为9g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是氧化还原反应 | B. | Cu是氧化剂 | ||
| C. | CO是还原剂 | D. | 该反应中有电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
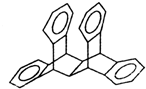 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是| A. | 该有机物的一氯代物只有4种(不包括立体异构) | |
| B. | 该有机物完全燃烧生成CO2和H2O的物质的量之比为15:11 | |
| C. | 该有机物属于苯的同系物 | |
| D. | 该有机物只能发生取代反应而不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入NaHCO3溶液会抑制水的电离 | |
| B. | 35℃时纯水中c(H+)>c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | c(H+)随着温度的升高而降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨基钠和氢化钠与盐酸反应都只生成一种盐 | |
| B. | 方程式②中,每生成1mol H2转移1 mol电子 | |
| C. | 熔融氢化钠不导电 | |
| D. | 方程式①中,氨基钠是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com