
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:| △c |
| △t |
| 0.5mol/L |
| 5min |
| 0.5 |
| 0.5×1.42 |
| 25 |
| 49 |
| 2 |
| 2×y2 |
| 25 |
| 49 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
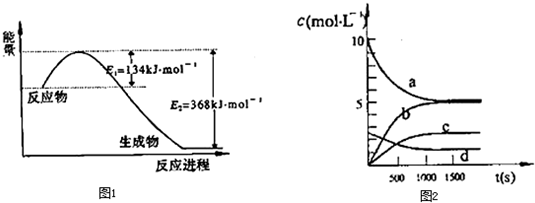
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
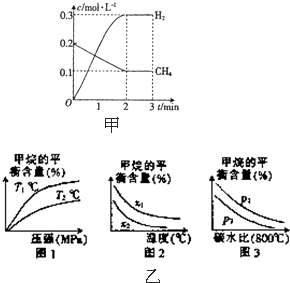 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.| t/min | n(CH4)/mol | n(H20)/mol | n(CO)/mol | n(H2)/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| C-O | C=O | C≡O | |
| CO | 357.7 | 798.9 | 1071. 9 |
| N-N | N=N | N≡N | |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
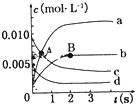 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(t) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com