
【题目】如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
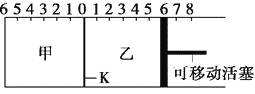
A. 根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B. 达到平衡后,隔板K最终停留在左侧刻度0~2之间
C. 达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D. 若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
【答案】D
【解析】
A.平衡移动,气体体积会发生变化,隔板随之滑动,当隔板不移动时,说明达到平衡状态,故A正确;
B. 2A(g)+B(g)![]() 2C(g),由于甲中充入2mol A和1molB,反应向正反应方向移动,A中压强降低,最多能转化为2molC,但是由于反应是可逆反应,所以C的物质的量在0~2mol之间,则达到平衡后,隔板K不再滑动,最终停留在左侧刻度0~2之间,故B正确;
2C(g),由于甲中充入2mol A和1molB,反应向正反应方向移动,A中压强降低,最多能转化为2molC,但是由于反应是可逆反应,所以C的物质的量在0~2mol之间,则达到平衡后,隔板K不再滑动,最终停留在左侧刻度0~2之间,故B正确;
C.隔板可以滑动,说明是等压条件,乙中充入1molHe,等于给甲加压,平衡右移,C的物质的量增大,则甲容器中C的物质的量大于乙容器中C的物质的量,故C正确;
D.“隔板K最终停留在左侧1处”,说明反应后气体体积为5格,即物质量为2.5mol,甲中气体的物质的量为2.5mol,乙中A、B、C三种气体的总量比甲中至少多1mol,即大于3.5mol,故乙中气体的体积要在6刻度右侧,故D错误;
答案选D。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )

A.容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g)![]() 2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)=_____mol
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是________
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是______
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。

A.加了催化剂 | B.缩小容器体积 |
C.降低温度 | D.增加SO3的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用图示装置制取氯气,下列说法不正确的是( )
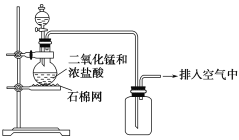
A. 该装置图中至少存在两处明显错误
B. 为了防止氯气污染空气,必须进行尾气处理
C. 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
D. 该实验中收集氯气的方法不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应m A(s)+n B(g) ![]() e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
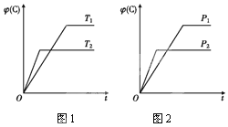
A.平衡后,若使用催化剂,C的体积分数将增大
B.平衡后,若温度升高,化学平衡向正反应方向移动
C.平衡后,增加A的质量化学平衡向正反应方向移动
D.化学方程式中,化学计量数的关系为n<e +f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物和碳氧化合物的综合治理是当前的重要课题之一。
已知:ⅰ.NO(g)+CO2(g)![]() NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1
ⅱ.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1
(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为______________。
(2)反应ⅰ的正反应的活化能E_____△H1(填“>”、“<”或“=”)。
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数________(填“增大”、“减少”或“无法确定”),原因为_____________________。
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是________(填选项字母)
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间______5 min(填“>”、“<”或“=”)。
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
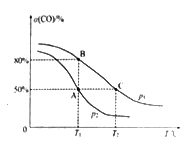
①A、B、C 三点的平衡常数KA、KB、KC的大小关系为________;p1和p2的大小关系为__________。
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中,用CO2和H2在催化剂的作用下合成甲醇,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),将1molCO2和3molH2在装有催化剂的反应器中反应8小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示。下列说法正确的是( )
CH3OH(g)+H2O(g),将1molCO2和3molH2在装有催化剂的反应器中反应8小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示。下列说法正确的是( )

A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的△H>0
CH3OH(g)+H2O(g)的△H>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2转化率
D.![]() 下,X点所对应甲醇的产率为50%,则平衡常数K=0.15
下,X点所对应甲醇的产率为50%,则平衡常数K=0.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合碱式氯化铁[![]() (m为聚合度)为无机高分子絮凝剂,广泛应用于水处理。以铁矿石、氧化铁皮或
(m为聚合度)为无机高分子絮凝剂,广泛应用于水处理。以铁矿石、氧化铁皮或![]() 为原料,在酸性条件下经氧化、水解、聚合、熟化等步骤,可制得聚合碱式氯化铁。
为原料,在酸性条件下经氧化、水解、聚合、熟化等步骤,可制得聚合碱式氯化铁。
(1)钢铁酸洗废液中主要含有![]() 和
和![]() ,通入空气可制得
,通入空气可制得![]() ,反应的化学方程式________。氧化剂
,反应的化学方程式________。氧化剂![]() 也可以将
也可以将![]() 氧化成
氧化成![]() ,但存在的缺点是________________。
,但存在的缺点是________________。
(2)“氧化”过程中,若盐酸的浓度或投入量增大,除了会降低![]() 的转化率,还可能产生的影响为________________。
的转化率,还可能产生的影响为________________。
(3)①准确称取聚合碱式氯化铁样品1.5000g,置于250mL的锥形瓶中,加入适量稀盐酸,加热,迅速加入稍过量的![]() 溶液(
溶液(![]() 被
被![]() 氧化成为
氧化成为![]() ),充分反应后,多余的
),充分反应后,多余的![]() 用
用![]() 氧化除去。再加入适量的
氧化除去。再加入适量的![]() 组成的混酸及4~5滴指示剂,用
组成的混酸及4~5滴指示剂,用![]() 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() ),消耗
),消耗![]() 溶液
溶液![]() 。
。
②另称取等质量的聚合碱式氯化铁样品溶于水中,配成500mL溶液,取25mL溶液于锥形瓶中,用铬酸钾(![]() )溶液作指示剂,用
)溶液作指示剂,用![]() 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗![]() 溶液8.10mL。
溶液8.10mL。
计算该样品中氯元素和铁元素的质量分数之比![]() 为________(写出计算过程,结果保留四位有效数字)。
为________(写出计算过程,结果保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)
A. Q1+Q2+Q3B. 1.5Q1-0.5Q2+0.5Q3
C. 0.5Q1-1.5Q2+0.5Q3D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com