
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:

(1)等质量的上述烃燃烧耗氧量最高的是(填对应字母)__;
(2)属于同系物的是(填对应字母)___;
(3)所有原子都在同一平面上的是(填对应字母)___;
(4)一卤代物总类最多的是(填对应字母)___;
(5)实验室制D的化学方程式___;
(6)写出G合成烈性炸药(TNT)的化学方程式___。
【答案】A ABE,FG CDF G CaC2+2H2O→Ca(OH)2+CH≡CH↑ ![]() +3HNO3
+3HNO3![]()
 +3H2O
+3H2O
【解析】
有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,根据物质的组成、结构和性质解答该题。
有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯;
(1)设烃的分子式为CxHy,耗氧量=x+![]() ,根据其分子式知,x+
,根据其分子式知,x+![]() 最大的是甲烷,所以等质量的上述烃耗氧量最多的是A;
最大的是甲烷,所以等质量的上述烃耗氧量最多的是A;
(2)结构相似,分子组成相差若干CH2的有机物互为同系物,则甲烷、乙烷、丙烷互为同系物,苯和甲苯互为同系物,故答案为ABE和FG;
(3)乙烯和苯均为平面结构,乙炔是直线型结构,则所有原子都在同一平面上的是CDF;
(4)分子中有几种等效氢原子就有几种一氯代物,其中甲苯有4种等效氢,则一卤代物种类最多的是G;
(5)实验室利用碳化钙和饱和食盐水制乙炔,发生反应的化学方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(6)甲苯和浓硝酸、浓硫酸的混合液混合加热制得烈性炸药(TNT),发生反应的化学方程式为![]() +3HNO3
+3HNO3![]()
 +3H2O。
+3H2O。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期元素的第一电离能随原子序数的增大,总趋势逐渐增大。镓![]() 的基态电子排布式是_____,
的基态电子排布式是_____,![]() 的第一电离能明显低于
的第一电离能明显低于![]() ,原因是______。
,原因是______。
(2)多酚氧化酶与植物的抗病性有关。配合物![]() 是多酚氧化酶的模型配合物。
是多酚氧化酶的模型配合物。
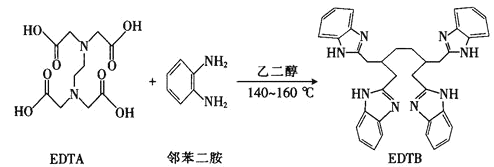
![]() 一个EDTA分子中
一个EDTA分子中![]() 键的数目为______________。
键的数目为______________。
![]() 分子中所含元素的电负性由小到大的顺序为______________________。
分子中所含元素的电负性由小到大的顺序为______________________。
![]() 与
与![]() 互为等电子体的一种阴离子为___________________。
互为等电子体的一种阴离子为___________________。
![]() 配离子
配离子![]() 中的配位原子是__________________。
中的配位原子是__________________。
(3)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,再向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是____________________________________________![]() 用相关的离子方程式和简单的文字说明加以解释
用相关的离子方程式和简单的文字说明加以解释![]() 。
。
(4)![]() 溶解在NaOH溶液中,可得到钒酸钠
溶解在NaOH溶液中,可得到钒酸钠![]() ,该盐阴离子中V的杂化轨道类型为______________;也可以得到偏钒酸钠,其阴离子呈如图1所示的无限链状结构,则偏钒酸钠的化学式为_________________________。
,该盐阴离子中V的杂化轨道类型为______________;也可以得到偏钒酸钠,其阴离子呈如图1所示的无限链状结构,则偏钒酸钠的化学式为_________________________。

(5)钒的某种氧化物晶胞结构如图2所示。该氧化物的化学式为_____________,若它的晶胞参数为![]() ,则晶胞的密度为__________
,则晶胞的密度为__________![]() 写计算式
写计算式![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )
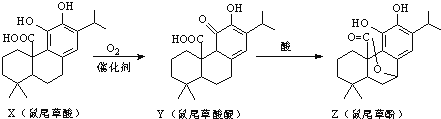
A.X、Y、Z分子中均含有2个手性碳原子
B.X、Y、Z均能与FeCl3溶液发生显色反应
C.1molY最多能消耗2molH2
D.1molZ与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纤维素为主要原料制备乙酸乙酯的路线如下:

下列说法正确的是![]()
A.![]() 和
和![]() 都发生了氧化还原反应
都发生了氧化还原反应
B.M虽然分子结构中无醛基,但仍然可以发生银镜反应
C.步骤![]() ,1molM完全反应可以生成3mol乙醇
,1molM完全反应可以生成3mol乙醇
D.若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH—ΔH>0,下列叙述正确的是( )
H++OH—ΔH>0,下列叙述正确的是( )
A.向水中加入氢氧化钠,平衡逆向移动,c(H+)降低,c(OH―)增大
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
C.向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,c(H+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3;NO能被酸性高锰酸钾氧化为NO3-。下列说法正确的是( )

A.可将B中的药品换为浓硫酸
B.实验开始前通一段时间CO2,可制得比较纯净的NaNO2
C.开始滴加稀硝酸时,A中会有少量红棕色气体
D.装置D中溶液完全褪色后再停止滴加稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ/mol;2NO(g)+O2(g)
2SO3(g) ΔH=-196.6kJ/mol;2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJ/mol;
2NO2(g) ΔH=-113.0kJ/mol;
①则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH的ΔH=___kJ/mol。
SO3(g)+NO(g) ΔH的ΔH=___kJ/mol。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1molNO2
③测得上述反应平衡时NO2与SO2的体积比为1:6,则平衡常数K=___。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
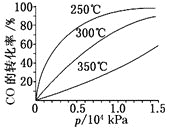
该反应ΔH___0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的硫酸溶液
的硫酸溶液![]() 的溶质质量分数为
的溶质质量分数为![]() 将此浓硫酸缓慢加入水中,下列结论正确的是( )
将此浓硫酸缓慢加入水中,下列结论正确的是( )
A.若水的体积与浓硫酸的体积比为3:1,稀释后溶液的物质的量浓度为![]()
B.若水的体积与浓硫酸的体积比为3:1,稀释后溶液中溶质质量分数为![]()
C.若水的质量与浓硫酸的质量之比为3:1,稀释后溶液的物质的量浓度为![]()
D.若水的质量与浓硫酸的质量比为3:1,稀释后溶液溶质质量分数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com