
| 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 | |
| A | 苯(苯酚) | ||
| B | 乙酸乙酯(乙酸) | ||
| C | 乙醇(水) |
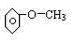 .
.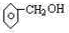 .
. .
. 分析 (1)A.苯酚与NaOH反应后,与苯分层;
B.乙酸与饱和碳酸钠反应后,与乙酸乙酯分层;
C.CaO与水反应后,增大与乙醇的沸点差异;
(2)该分子的不饱和键=$\frac{7×2+2-8}{2}$=4,苯环相当于4个不饱和键,
①不能与金属钠反应,说明该物质不含羟基,则该物质为醚;
②能与钠反应,但遇FeCl3不显色则该物质为醇;
③能与钠反应且遇FeCl3显紫色,则该物质含有甲基和酚羟基.
解答 解:A.苯酚与NaOH反应后,与苯分层,则试剂为NaOH溶液,分离方法为分液;
B.乙酸与饱和碳酸钠反应后,与乙酸乙酯分层,则试剂为饱和碳酸钠溶液,分离方法为分液;
C.CaO与水反应后,增大与乙醇的沸点差异,则试剂为CaO,分离方法为蒸馏,
故答案为:
| 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 | |
| A | 苯(苯酚) | NaOH溶液 | 分液 |
| B | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| C | 乙醇(水) | CaO(生石灰)固体 | 蒸馏 |
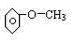 ,故答案为:
,故答案为: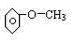 ;
;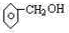 ,故答案为:
,故答案为: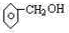 ;
; ,故答案为:
,故答案为: .
.点评 本题考查有机物的结构与性质及混合物分离提纯,为高频考点,把握有机物的组成、性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| B. | 1mol甲烷最多与2molCl2发生取代反应 | |
| C. | 标准状况下,2.24L乙醇含有的分子数目为0.1NA | |
| D. | 0.5 mol苯分子中含有C=C双键数为1.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L苯含有的分子数为0.1NA | |
| B. | 常温常压下,18g H2O含有10nA个电子 | |
| C. | 1L1mol•L-1的NH4Cl溶液中有nA个NH4+ | |
| D. | 一定条件下,向密闭容器中投入3mol H2和1mol N2充分反应后可得到NH3分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com