
| A. | 电池放电时,PbO2是电池的正极,被氧化 | |
| B. | 电池放电时,SO42-只在负极发生反应 | |
| C. | 电池放电时,溶液的pH不断减小 | |
| D. | 电池放电时,正极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
分析 充电时,阳极发生氧化反应,阴极发生还原反应,是放电时的逆反应,阴极电极反应式为PbSO4+2e-=Pb+SO42-,而阳电极反应式为PbSO4+2H2O-2e-═PbO2+SO42-+4H+,由此分析解答.
解答 解:A.放电时,Pb失电子作负极、二氧化铅作正极,正极上得电子发生还原反应被还原,故A错误;
B.放电时,电解质溶液中负极反应式为Pb(s)+SO42-(aq)-2e-=PbSO4(s),正极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,所以正负极上硫酸根离子都参加反应,故B错误;
C.充放电时氢离子的浓度减少,溶液的pH不断增大,故C错误;
D.电池放电时,正极PbO2发生还原反应,电极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O,故D正确;
故选D.
点评 本题考查常见化学电源电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:解答题
 (或
(或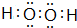
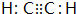 等);
等);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③④ | C. | ①② | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
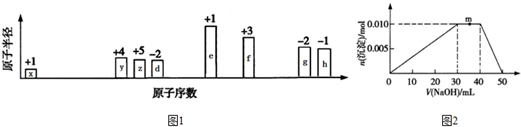
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于稀HNO3溶液:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 使用催化剂 | ||
| C. | 降低压强 | D. | 升高反应温度加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶胞是晶体的最小的结构重复单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都属于该晶胞 | |
| D. | 已知晶胞的组成不能推知晶体的组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NCl3、CH4 | ||
| C. | BCl3、CH2═CH2、环己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.
结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com