
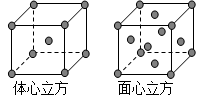
 (2)S或Si (3)硒 (4)三角锥形、V形
(2)S或Si (3)硒 (4)三角锥形、V形  /8
/8 。
。 ,而面心立方晶胞中有
,而面心立方晶胞中有 ,所以二者的密度之比是3
,所以二者的密度之比是3 /8。
/8。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题

| A.非金属性:Y>Z>M |
| B.原子半径:M>Z>Y |
| C.气态氢化物的稳定性:Y<M<Z |
| D.ZM2分子中各原子的最外层电子均满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢化物的稳定性HF>HCl>H2S>PH3>SiH4 |
| B.微粒半径K+>Al3+>S2->Cl- |
| C.酸性:H2SO4>CH3COOH >H2CO3>HClO |
| D.金属性:K > Ca > Mg > Be |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相 关 信 息 |
| R | R在周期表中的周期数、族序数与其原子序数均相等 |
| X | X原子形成的化合物种类最多 |
| Y | Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
| Z | Z原子的最外层电子数为K层电子数的3倍 |
| Q | Q存在质量数为23,中子数为12的核素 |
| W | W在所处周期中原子半径最小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H2SO4>HClO4 | B.氧化性:Fe3+>Fe2+ |
| C.稳定性:HBr<HCl | D.原子半径 Na>Mg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在化工生产中应遵循“绿色化学”的思想 |
| B.控制实验条件可以改变化学反应的限度和速率 |
| C.在元素周期表的金属和非金属分界线附近寻找半导体材料 |
| D.根据元素周期律,由HClO4可以类推出氟元索也存在最高价氧化物的水化物HFO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com