
| … | E | A | B | ||
| C | … | D |
分析 A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的气态氢化物水溶液呈碱性,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,结合元素化合物的性质和元素周期律解答.
解答 解:A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的气态氢化物水溶液呈碱性,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,
(1)N的最高价氧化物对应的水化物与其氢化物反应生成离子化合物的化学式为 NH4NO3;
故答案为:NH4NO3;
(2)由Na、O、Al三种元素构成的化合物为NaAlO2,含有的化学键有共价键和离子键;
故答案为:共价键和离子键;
(3)A与B可组成质量比为7:16的三原子分子,N、O原子数目之比为$\frac{7}{14}$:$\frac{16}{16}$=1:2,该分子为NO2,可引起酸雨和光化学烟雾,
故答案为:①③;
(4)Cu与FeCl3溶液反应生成氯化铜和氯化亚铁,该反应设计为原电池,铜应为负极,石墨为正极,其反应中正极附近氯化铁失电子变为亚铁离子,正极电极方程式为:2Fe3++2e-=2Fe2+;
故答案为:2Fe3++2e-=2Fe2+.
点评 本题考查位置结构关系的相互应用,明确元素的推断是解答的关键,并利用化学键、周期表、电化学等知识点来解答即可,题目难度中等,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:实验题
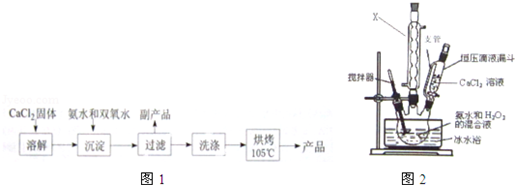
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
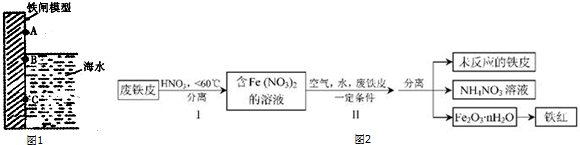
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
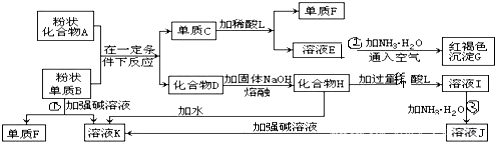
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
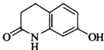 的水解产物互为同分异构体,能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种.写出两种满足上述条件的结构简式:
的水解产物互为同分异构体,能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种.写出两种满足上述条件的结构简式: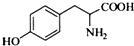 、
、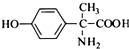 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
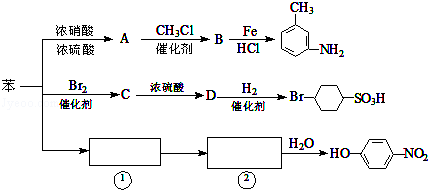
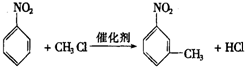 .
.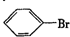 ,②
,②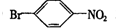 .
.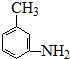 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成、酯化、缩聚 | B. | 加成、加成、加聚 | C. | 加成、消去、加聚 | D. | 加成、取代、缩聚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
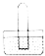
| A. | 若水槽中是水,试管中是CH4和Cl2,光照后可看到液面上升,有油状物产生 | |
| B. | 若水槽中是水(并滴有一定量酚酞),试管中是NH3可看到液面上升并呈红色 | |
| C. | 若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管 | |
| D. | 若水槽中和试管中都是氯水,光照后可在试管中收集到氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com