
 (1)三聚氰胺分子的结构简式如图1所示,则其中氮原子轨道杂化类型是
(1)三聚氰胺分子的结构简式如图1所示,则其中氮原子轨道杂化类型是
| 晶胞中C、Si原子总体积 |
| 晶胞体积 |
| 1 |
| 8 |
| 1 |
| 2 |
| 4 |
| 3 |
| b |
| 2 |
| 2 |
| 3 |
| 4 |
| 3 |
| c |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| ||
| a3 cm3 |
| 2π(b3+c3) |
| 3a3 |
| 2π(b3+c3) |
| 3a3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、在CH4、O2和KOH溶液组成的燃料电池中,负极反应式为:CH4-8e-+10OH-═CO
| ||
B、将SO2通入次氯酸钠溶液中:SO2+2ClO-+H2O═SO
| ||
| C、乙烯的燃烧热为a kJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C2H4(g)+3O2(g)═2CO2(g)+2H2O(g),△H=-akJ/mol | ||
D、向苯酚钠(C6H5ONa)溶液中通入少量二氧化硫:C6H5O-+SO2+H2O→C6H5OH+HSO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、SO42-、NO3- |
| B、Ca2+、Mg2+、HCO3-、NO3- |
| C、Na+、Fe2+、AlO2-、Br- |
| D、K+、Na+、SiO32-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.5mol/L FeCl3溶液中含Fe3+的数目为0.5NA |
| B、34g10%的双氧水中,含有的共价键数目为3NA |
| C、氯化钠晶体中一个钠离子周围距离最近的氯离子的数目为6个 |
| D、用含有0.1 mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KSP(PbS)<Ksp(CuS) |
| B、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++s2-=CuS↓ |
| D、在自然界也发生着溶解度小的矿物转化为溶解度更小的矿物的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
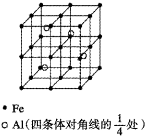 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学一物质结构与性质]
[化学一物质结构与性质]查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com