
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.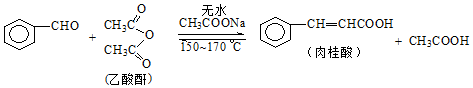
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |

分析 (1)该反应在150~170℃的条件下进行,根据表中各物质的沸点可知,反应物在这个条件下易挥发;
(2)乙酸酐遇水易水解,所以反应中不能有水;由于该反应的条件为150~170℃,可以用空气浴(或油浴)控制;
(3)在150~170℃时乙酸酐易挥发;
(4)肉桂酸难溶于水,肉桂酸钠易溶于水;
(5)要使肉桂酸从溶液中充分析出,要冷却结晶,提高纯度可以进行重结晶;
(6)5.3g苯甲醛的物质的量为0.05mol,5.6g乙酸酐的物质的量为0.05mol,根据题中反应的方程式可知,理论上生成肉桂酸的质量为0.05mol×148g/mol=7.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)该反应在150~170℃的条件下进行,根据表中各物质的沸点可知,反应物在这个条件下易挥发,所以空气冷凝管的作用是使反应物冷凝回流,使反应物充分反应,
故答案为:使反应物冷凝回流;
(2)由于该反应的条件为150~170℃,可以用空气浴(或油浴)控制,乙酸酐遇热水易水解,所以反应中不能有水,醋酸钠晶体(CH3COONa•3H2O)参加反应会有水,使乙酸酐水解,
故答案为:空气浴(或油浴);乙酸酐遇热水水解;
(3)在150~170℃时乙酸酐易挥发,如果剧烈沸腾,乙酸酐蒸出,反应物减少,平衡左移,导致肉桂酸产率降低,
故答案为:乙酸酐蒸出,反应物减少,平衡左移;
(4)肉桂酸难溶于水,肉桂酸钠易溶于水,加饱和Na2CO3溶液将肉桂酸转化为肉桂酸钠,溶解于水,便于物质提纯,
故答案为:将肉桂酸转化为肉桂酸钠,溶解于水;
(5)要使肉桂酸从溶液中充分析出,要冷却结晶,故操作Ⅰ为冷却结晶,提高纯度可以进行重结晶,
故答案为:加热浓缩、冷却结晶;重结晶;
(6)5.3g苯甲醛的物质的量为0.05mol,5.6g乙酸酐的物质的量为0.05mol,根据题中反应的方程式可知,理论上生成肉桂酸的质量为0.05mol×148g/mol=7.4g,产率=$\frac{5.0g}{7.4g}$×100%=67.6%,
故答案为:67.6%.
点评 本题考查了物质制备实验的过程分析判断,反应实质和反应条件的分析判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | S2-的结构示意图: | |
| D. | 甲烷分子的比例模型是 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精盐 | B. | 石灰石粉 | ||
| C. | 可溶的钙和镁的碳酸氢盐 | D. | 胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有CO32- | |
| B. | 加入盐酸酸化的氯化钡,溶液中有白色沉淀产生,溶液中不一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为ls22s2的Y原子 | |
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 | |
| C. | 2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子 | |
| D. | 同一主族的X原子和Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水为原料而获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com