
| A. | 任何晶体中都存在化学键 | |
| B. | 晶体内部的微粒在空间的排列均服从紧密堆积原理 | |
| C. | 任何晶体中,若有阴离子必定含有阳离子 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
分析 A、单原子分子中不存在化学键;
B、共价键具有饱和性和方向性导致了原子晶体中原子的堆积不属于密堆积;
C、晶体中有阴离子一定含有阳离子;
D、金属晶体的熔点不一定高.
解答 解:A、稀有气体都是单原子分子,不存在化学键,只存在分子间作用力,故A错误;
B、共价键具有饱和性和方向性导致了原子晶体中原子的堆积不属于密堆积,故B错误;
C、晶体中有阴离子,根据物质中电荷守恒知,一定含有阳离子中和阴离子所带电荷,故C正确;
D、金属晶体的熔点不一定比分子晶体的熔点高,W的熔点较低,故D错误;
故选C.
点评 本题考查了化学键以及晶体内部结构等的有关知识,根据化学键的概念来分析解答,注意分子间作用力不属于化学键,为易错点.


科目:高中化学 来源: 题型:填空题
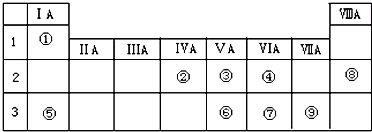
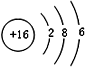 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子排布相同的微粒,其化学性质也相同 | |
| B. | 含有金属元素和非金属元素的化合物不一定是离子化合物 | |
| C. | 仅含非金属元素的化合物一定是共价化合物 | |
| D. | 凡需要加热的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
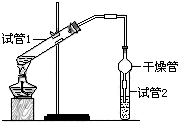 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

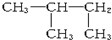



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com