
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是
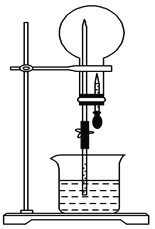
A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
科目:高中化学 来源: 题型:
【题目】交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是
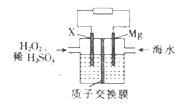
A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2 mol电子,则有2 mol H+由质子交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下:
加氨水体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
(1)所测土壤的酸碱性如何?
(2)所用氨水的pH和c(OH﹣)分别为多少?
(3)为使该滤液呈中性,所加入氨水的恰当体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.3 mol氧气和0.2 mol臭氧(O3)的
A. 分子数相等 B. 体积相等
C. 标准状况下体积比是2:3 D. 标准状况下的体积比是3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产生活和科学研究中具有重要的作用。下列说法正确的是( )
①耐高温的碳化硅陶瓷是新型无机非金属材料
②现代建筑物大量使用的玻璃和水泥都是硅酸盐材料
③单质硅可以用来制造太阳能电池
④水晶项链和陶瓷都是硅酸盐材料
A.①②③B.②③④C.①②④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。已知部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
a.Na2O2 b.HNO3 c.FeCl3 d.KMnO4
(2)加入NaOH溶液调溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子__________(填序号)。
a.Fe3+ b.Al3+ c.Ca2+ d.Mg2+
II.酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。该法用Fe、石墨分别作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3和Fe(OH)3
(3)电解时连接铁棒的一极是电源的_________极。
(4)写出电解时阳极的电极反应式____________________;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________;
(5)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至1×10-5molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如以下左图所示。

根据判断出的元素回答问题:
(1)A、B均为以上某两种元素组成的分子,A中有四个原子核和10个电子,B中有6个原子核和18个电子,则A的分子式为________,B的分子式为_________。
(2)比较e、f离子的半径大小(用元素离子符号表示)__________________;非金属性g_____h(填“强于”或“弱于”),用一个化学方程式证明你的推论 ________。
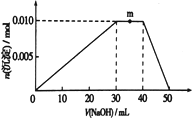
(3)上述元素可组成盐R【化学式为zx4f(gd4)2】,向盛有10mL1mol·L1R溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如以上右图:
①上述NaOH溶液物质的量的浓度为_________________________。
②写出m点反应的离子方程式______________________________。
③若向R溶液中改加20mL1.1mol·L1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明酸性溶液中,下列各组离子能大量共存的是( )
A.Na+、K+、OH-、Cl-
B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-
D.K+、Na+、NO3-、ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com