
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | 热的纯碱溶液用于清洗油污 | |
| C. | 次氯酸钠常用作消毒剂 | |
| D. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
分析 A、TiCl4溶液水解生成H2TiO3,钛酸加热分解生成二氧化钛;
B、纯碱水解显碱性;
C、次氯酸钠具有强氧化性;
D、向沸水中滴加少量的FeCl3溶液,FeCl3水解生成Fe(OH)3胶体.
解答 解:A、四氯化钛在热水中水解:TiCl4+3H2O?H2TiO3+4HCl,钛酸受热分解:H2TiO3$\frac{\underline{\;△\;}}{\;}$TiO2+H2O,与盐类水解有关,故A错误;
B、纯碱为强碱弱酸盐,水解呈碱性,油污在碱性条件下水解较完全,可用于油污的清洗,故B错误;
C、次氯酸钠本身具有强氧化性,可用于杀菌消毒,与盐的水解无关,故C正确;
D、向沸水中滴加少量的FeCl3溶液生成氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,故D错误.
故选C.
点评 本题考查了盐类水解的原理和应用,应注意的是次氯酸钠本身有强氧化性,能杀菌消毒.


科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:计算题
乙烯(C2H4)和乙烷(C2H6)的混合气体共amol,与bmolO2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45gH2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)= 。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的2/3时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
(3)a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
已知反应①2BrO3﹣+Cl2=Br2+2ClO3﹣;②5Cl2+I2+6H2O=2HIO3+10HCl;③ClO3﹣+5Cl﹣+6H+=3Cl2+3H2O,下列有关氧化(还原)能力强弱顺序正确的是( )
A.还原性:C l﹣>I2>Br2>Cl2 B.还原性:Cl﹣>I2>Cl2>Br2
l﹣>I2>Br2>Cl2 B.还原性:Cl﹣>I2>Cl2>Br2
C.氧化性:BrO3﹣>ClO3﹣>Cl2>IO3﹣ D.氧化性:Cl2>BrO3﹣>C1O3﹣>IO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
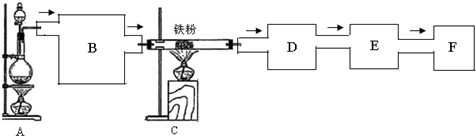

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 大于0.2mol小于0.4mol | ||
| C. | 0.2mol | D. | 小于0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指某一时刻,某种反应物的瞬时反应速率 | |
| B. | 化学反应速率为0.8mol•L-1•s-1是指反应1 s时某物质的浓度为0.8mol•L-1 | |
| C. | 对于一个化学反应来说,其反应速率越大,反应现象就越明显 | |
| D. | 根据化学反应速率的大小可以推知化学反应进行的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
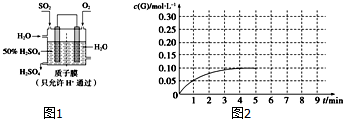
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的二氧化硅晶体广泛用作制造光导纤维和太阳能电池板材料 | |
| B. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 | |
| C. | 高温下杀死H7N9,不属于蛋白质变性 | |
| D. | 用含有橙色酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的挥发性和还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com