
 .
. 、
、 、
、 (其中三种).
(其中三种).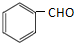 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为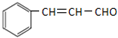 .
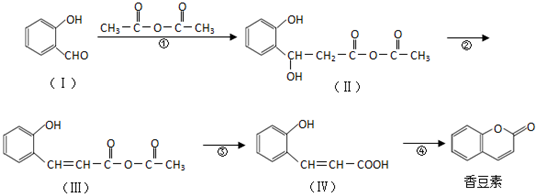
. 分析 (1)根据有机物Ⅰ结构简式判断含有的原子个数,可确定分子式,根据Ⅳ分子结构可知,Ⅳ中酚羟基邻对位上氢可被溴取代,酚羟基与羧基与氢氧化钠反应,据此判断各自的物质的量;
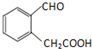
(2)根据物质Ⅱ和Ⅲ的结构可知反应②的类型,比较Ⅳ和香豆素的结构可知反应②的反应类型;
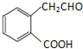
(3)香豆素水解可生成酚羟基和羧基,二者都能与NaOH反应;
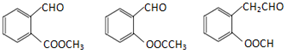
(4)根据条件:①苯分子中含有苯环且无碳碳双键,②苯环上含有两个邻位取代基,③能发生银镜反应,说明含有-CHO,结合Ⅳ的结构可知Ⅴ的结构简式;
(5)反应①、②分别为加成反应和消去反应,生成C=C,据此可判断最终生成的有机物的结构简式.
解答 解:(1)根据有机物Ⅰ结构简式可知Ⅰ的分子中含有7个C、6个H、2个O,则分子式为C7H6O2,Ⅳ中酚羟基邻对位上氢可被溴取代,酚羟基与羧基与氢氧化钠反应,1mol (Ⅳ)分别 与饱和溴水、NaOH反应,消耗Br2、NaOH物质的量之比为3:2,
故答案为:C7H6O2;3:2;
(2)根据物质Ⅱ和Ⅲ的结构可知反应②为消去反应,比较Ⅳ和香豆素的结构可知反应②为酯化反应,
故答案为:消去反应;酯化(取代)反应;
(3)香豆素水解可生成酚羟基和羧基,二者都能与NaOH反应,反应的方程式为 ,
,
故答案为: ;
;
(4)根据条件:①苯分子中含有苯环且无碳碳双键,②苯环上含有两个邻位取代基,③能发生银镜反应,说明含有-CHO,结合Ⅳ的结构可知符合这样条件的Ⅳ的同分异构体为

 ,
,
故答案为:

 (其中三种);
(其中三种);
(5)反应①、②分别为加成反应和消去反应,生成C=C,所以一定条件下, 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为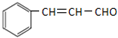 ,
,
故答案为: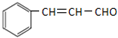 .
.
点评 本题考查有机物的合成,题目难度中等,本题侧重于有机物的官能团的性质、转化的考查,注意根据官能团的转化判断反应类型,易错点为(4),注意有机物同分异构体的判断.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CuSO4═Cu+2+SO4-2 | B. | NH4NO3═NH4++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | KClO3═K++Cl-+3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 050 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
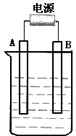 如图所示,在石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色固体物质生成,B电极有黄绿色气体生成,能使淀粉碘化钾试液变蓝.当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.回答下列问题.
如图所示,在石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色固体物质生成,B电极有黄绿色气体生成,能使淀粉碘化钾试液变蓝.当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8.48 g | B. | 7.48 g | C. | 5.72 g | D. | 5.22g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com