
”¾ĢāÄæ”浞µŖ»ÆĪļŹĒŅ»ĄąÖŲŅŖ»ÆŗĻĪļ£¬ŌŚÕØŅ©”¢“ÅŠŌ»ÆŗĻĪļŃŠ¾æ”¢Ī¢ĮæŌŖĖŲ²ā¶Ø·½ĆęŌ½Ą“Ō½ŅżĘšČĖĆĒµÄÖŲŹÓ£¬ĘäÖŠĒāµžµŖĖį(HN3)ŹĒŅ»ÖÖČõĖį£¬·Ö×Ó½į¹¹Ź¾ŅāĶ¼æɱķŹ¾ĪŖ£ŗ
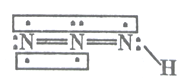
ĮŖ°±±»ŃĒĻõĖįŃõ»ÆŹ±±ćæÉÉś³ÉĒāµžµŖĖį(HN3)£ŗN2H4+HNO2=2H2O+HN3£¬ĖüµÄĖįŠŌĄąĖĘÓŚ“×Ėį£¬Ī¢ČõµēĄė³öH+ŗĶN3-”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)“ӳɼüŌ×ӵĵēøŗŠŌ½Ē¶Č£¬HN3ÖŠŗ¬ÓŠµÄ¹²¼Ū¼üĄąŠĶĪŖ_______________£¬·Ö×ӵļ«ŠŌĪŖ_____________”£
(2)µžµŖ»ÆĪļÄÜÓėFe3+”¢Cu2+”¢Co3+µČŠĪ³ÉÅäŗĻĪļ£¬Čē£ŗCo[(N3)(NH3)5]SO4£¬ŌŚøĆÅäŗĻĪļÖŠīÜĻŌ_________¼Ū£¬øł¾Ż¼Ū²ć»„³āĄķĀŪæÉÖŖSO42-æÕ¼äŠĪדĪŖ______________£¬Š“³öīÜŌ×ÓŌŚ»łĢ¬Ź±µÄŗĖĶāµē×ÓÅŲ¼Ź½_____________”£
(3)ÓɵžµŖ»ÆÄĘ(NaN3)ČČ·Ö½āæɵƓæN2£ŗ2NaN3(s)=2Na(l)+3N2(g)£¬ÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ__________(Ń”ĢīŠņŗÅ)
A.NaN3ÓėKN3½į¹¹ĄąĖĘ£¬Ē°Õß¾§øńÄܽĻŠ”
B.ÄĘ¾§°ū½į¹¹ČēĶ¼![]() £¬¾§°ūÖŠ·ÖĢÆ2øöÄĘŌ×Ó
£¬¾§°ūÖŠ·ÖĢÆ2øöÄĘŌ×Ó
C.µŖµÄµŚŅ»µēĄėÄÜ“óÓŚŃõ
D.µŖĘų³£ĪĀĻĀŗÜĪČ¶Ø£¬ŹĒŅņĪŖµŖµÄµēøŗŠŌŠ”
(4)ÓėN3-»„ĪŖµČµē×ÓĢåµÄ·Ö×ÓÓŠ___________________ (¾Ł2Ąż£©
(5)ČĖŌģĮ¢·½µŖ»ÆÅšµÄÓ²¶Č½ö“ĪÓŚ½šøÕŹÆ¶ųŌ¶Ō¶øßÓŚĘäĖū²ÄĮĻ£¬Ņņ“ĖĖüÓė½šøÕŹÆĶ³³ĘĪŖ³¬Ó²²ÄĮĻ”£Į¢·½µŖ»ÆÅš¾§°ūČēĶ¼ĖłŹ¾£¬ŹŌ·ÖĪö£ŗ
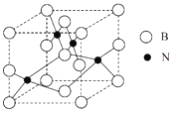
¢ŁøĆ¾§ĢåµÄĄą±šĪŖ____________¾§Ģ唣
¢Ś¾§ĢåÖŠĆæøöNĶ¬Ź±ĪüŅż________øöB”£
¢ŪÉčøĆ¾§ĢåµÄĦ¶ūÖŹĮæĪŖMg”¤mol-1£¬¾§ĢåµÄĆܶČĪŖ¦Ńg”¤cm-3£¬°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµĪŖNA£¬Ōņ¾§ĢåÖŠĮ½øö¾ąĄė×ī½üµÄBÖ®¼äµÄ¾ąĄėĪŖ___________cm”£
”¾“š°ø”æ ¼«ŠŌ¼ü”¢·Ē¼«ŠŌ¼ü ¼«ŠŌ·Ö×Ó +3 ÕżĖÄĆęĢå ls22s22p63s23p63d74s2»ņ[Ar]3d74s2 BC N2O”¢CO2”¢CS2”¢BeF2µČ Ō×Ó 4 ![]()
”¾½āĪö”æ(1) HN3ÖŠŗ¬ÓŠµÄ¹²¼Ū¼üÓŠH-N¼«ŠŌ¼üŗĶN=N·Ē¼«ŠŌ¼ü£¬øł¾Ż½į¹¹æÉÖŖ£¬øĆ·Ö×ÓĪŖVŠĪ·Ö×Ó£¬µēŗÉ·Ö²¼²»¾łŌČ£¬ŹōÓŚ¼«ŠŌ·Ö×Ó£¬¹Ź“š°øĪŖ£ŗ¼«ŠŌ¼ü”¢·Ē¼«ŠŌ¼ü£»¼«ŠŌ·Ö×Ó£»
(2)øĆÅäŗĻĪļÖŠµžµŖĖįøłĄė×ÓĪŖ-1¼Ū”¢ĮņĖįøłĄė×ÓĪŖ-2¼Ū£¬øł¾Ż»ÆŗĻĪļÖŠø÷ŌŖĖŲ»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖ0ÖŖ£¬CoŌŖĖŲ»ÆŗĻ¼ŪĪŖ+3¼Ū£»ĮņĖįøłĄė×Ó¼Ū²ćµē×Ó¶ŌøöŹżŹĒ4ĒŅ²»ŗ¬¹Āµē×Ó¶Ō£¬øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪÅŠ¶ĻĮņĖįøłĄė×Óæռ乹ŠĶĪŖÕżĖÄĆęĢåŠĪ£»CoŹĒ27ŗÅŌŖĖŲ£¬ĘäŌ×ÓŗĖĶāÓŠ27øöµē×Ó£¬øł¾Ż¹¹ŌģŌĄķŹéŠ“Ę仳Ģ¬Ō×ÓŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ1s22s22p63s23p63d74s2»ņ[Ar]3d74s2£¬¹Ź“š°øĪŖ£ŗ+3£»ÕżĖÄĆęĢ壻1s22s22p63s23p63d74s2»ņ[Ar]3d74s2£»
(3)A£®NaN3ÓėKN3½į¹¹ĄąĖĘ£¬ĒŅ¶žÕ߶¼ŹĒĄė×Ó¾§Ģ壬¾§øńÄÜÓėĄė×Ó°ė¾¶³É·“±Č£¬¼ŲĄė×Ó°ė¾¶“óÓŚÄĘĄė×Ó£¬ĖłŅŌĒ°Õß¾§øńÄÜ“óÓŚŗóÕߣ¬¹Ź“ķĪó£»B£®¾§°ūÖŠNaŌ×ÓøöŹż=8”Į![]() +1=2£¬¹ŹÕżČ·£»C£®Ķ¬Ņ»ÖÜĘŚŌŖĖŲ£¬ŌŖĖŲµŚŅ»µēĄėÄÜĖę×ÅŌ×ÓŠņŹżŌö“ó¶ų³ŹŌö“óĒ÷ŹĘ£¬µ«µŚIIA×唢µŚVA×åµŚŅ»µēĄėÄÜ“óÓŚĘäĻąĮŚŌŖĖŲ£¬ĖłŅŌµŚŅ»µēĄėÄÜN£¾O£¬¹ŹÕżČ·£»D£®µŖĘų·Ö×ÓÖŠŗ¬ÓŠµŖµŖČż¼ü£¬¼üÄܽĻ“󣬊ŌÖŹ½ĻĪČ¶Ø£¬¹Ź“ķĪó£»¹ŹŃ”BC£»
+1=2£¬¹ŹÕżČ·£»C£®Ķ¬Ņ»ÖÜĘŚŌŖĖŲ£¬ŌŖĖŲµŚŅ»µēĄėÄÜĖę×ÅŌ×ÓŠņŹżŌö“ó¶ų³ŹŌö“óĒ÷ŹĘ£¬µ«µŚIIA×唢µŚVA×åµŚŅ»µēĄėÄÜ“óÓŚĘäĻąĮŚŌŖĖŲ£¬ĖłŅŌµŚŅ»µēĄėÄÜN£¾O£¬¹ŹÕżČ·£»D£®µŖĘų·Ö×ÓÖŠŗ¬ÓŠµŖµŖČż¼ü£¬¼üÄܽĻ“󣬊ŌÖŹ½ĻĪČ¶Ø£¬¹Ź“ķĪó£»¹ŹŃ”BC£»
(4)Ō×ÓøöŹżĻąµČ¼Ūµē×ÓŹżĻąµČµÄĪ¢Į£»„ĪŖµČµē×ÓĢ壬ÓėN3-»„ĪŖµČµē×ÓĢåµÄ·Ö×ÓÓŠN2O”¢CO2”¢CS2”¢BeF2µČ£¬¹Ź“š°øĪŖ£ŗN2O”¢CO2”¢CS2”¢BeF2µČ£»
(5)¢ŁŌ×Ó¾§ĢåÓ²¶Č“ó£¬øĆ¾§ĢåÓ²¶Č“ó£¬ĖłŅŌĪŖŌ×Ó¾§Ģ壬¹Ź“š°øĪŖ£ŗŌ×Ó£»
¢ŚĆæøöNŌ×ÓĶ¬Ź±ĪüŅż4øöBŌ×Ó£¬ĖłŅŌĘäÅäĪ»ŹżŹĒ4£¬¹Ź“š°øĪŖ£ŗ4£»
¢Ū¾§ĢåÖŠĮ½øö¾ąĄė×ī½üµÄBÖ®¼äµÄ¾ąĄėĪŖ¾§°ūĄā³¤µÄ![]() ±¶£¬¾§°ūĄā³¤=
±¶£¬¾§°ūĄā³¤=![]() £¬Ōņ¾§ĢåÖŠĮ½øö¾ąĄė×ī½üµÄBÖ®¼äµÄ¾ąĄė=
£¬Ōņ¾§ĢåÖŠĮ½øö¾ąĄė×ī½üµÄBÖ®¼äµÄ¾ąĄė=![]() ”Į
”Į![]() cm=
cm=![]() ”Į
”Į![]() cm=
cm=![]() cm£¬¹Ź“š°øĪŖ£ŗ
cm£¬¹Ź“š°øĪŖ£ŗ![]() ”£
ӣ


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£ØŹµŃé»Æѧ£©Ä³æĪĶā»ī¶ÆŠ”×éŃ§ÉśÄ£ÄāŗōĪüĆę¾ßÖŠµÄŌĄķ£Ø¹żŃõ»ÆÄĘÓė³±ŹŖ¶žŃõ»ÆĢ¼·“Ó¦£©£¬Éč¼ĘÓĆĻĀĶ¼ĖłŹ¾µÄŅĒĘ÷Ą“ÖĘČ”ŃõĘų²¢²āĮæŃõĘųµÄĢå»ż£®ČēĶ¼ÖŠĮæĘų×°ÖĆEŹĒÓɼה¢ŅŅĮ½øł²£Į§¹Ü×é³É£¬ĖüĆĒÓĆĻšĘ¤¹ÜĮ¬ĶØ£¬²¢×°ČėŹŹĮæĖ®£®¼×¹ÜÓŠæĢ¶Č£Ø0”«50mL£©£¬¹©ĮæĘųÓĆ£»ŅŅ¹ÜæÉÉĻĻĀŅĘ¶Æ£¬ŅŌµ÷½ŚŅŗĆęøßµĶ£® 
ŹµŃéŹŅæɹ©Ń”ÓƵÄŅ©Ę·»¹ÓŠ£ŗĻ”ĮņĖį”¢ŃĪĖį”¢¹żŃõ»ÆÄĘ”¢Ģ¼ĖįÄĘ”¢“óĄķŹÆ”¢Ė®ŹŌ»Ų“š£ŗ
£Ø1£©ÉĻŹö×°ÖƵÄĮ¬½ÓĖ³ŠņŹĒ£ØĢīø÷½ÓæŚµÄ±ąŗÅ£¬ĘäÖŠĮ¬½Ó½ŗ¹Ü¼°¼Š³Ö×°ÖĆ¾łŹ”ĀŌ£©£ŗ £®
£Ø2£©×°ÖĆCÖŠ·ÅČėµÄ·“Ó¦ĪļŹĒŗĶ £®
£Ø3£©×°ÖĆAµÄ×÷ÓĆŹĒ £¬ ×°ÖĆBµÄ×÷ÓĆŹĒ £®
£Ø4£©ĪŖĮĖ½Ļ×¼Č·µŲ²āĮæŃõĘųµÄĢå»ż£¬³żĮĖ±ŲŠė¼ģ²éÕūøö×°ÖƵÄĘųĆÜŠŌÖ®Ķā£¬ŌŚ¶ĮČ”·“Ó¦Ē°ŗó¼×¹ÜÖŠŅŗĆęµÄ¶ĮŹż£¬ĒóĘä²īÖµµÄ¹ż³ĢÖŠ£¬Ó¦×¢ŅāŗĶ£ØĢīŠ“×ÖÄø±ąŗÅ£©£®
a£®ŹÓĻßÓė°¼ŅŗĆę×īµĶŹżĻąĘ½b£®µČ“żĘ¬æĢ£¬“żŅŅ¹ÜÖŠŅŗĆę²»ŌŁÉĻÉżŹ±£¬Į¢æĢ¶ĮŹż
c£®¶ĮŹżŹ±Ó¦ÉĻĻĀŅʶÆŅŅ¹Ü£¬Ź¹¼×”¢ŅŅĮ½¹ÜŅŗĆęĻąĘ½d£®¶ĮŹżŹ±²»Ņ»¶ØŹ¹¼×”¢ŅŅ¹ÜŅŗĆęĻąĘ½£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½üÄźĄ“ÓŠ¶ąøöĘ·Åʵďֻśµē³ŲŌų·¢Éś±¬ÕØŹĀ¹Ź£¬¹«ÖŚ¶Ōµē³Ų°²Č«ŠŌµÄÖŲŹÓ³Ģ¶ČŌ½Ą“Ō½øߣ¬Č¼ĮĻµē³Ų×÷ĪŖ°²Č«ŠŌÄܽĻŗƵÄŅ»Ąą»ÆѧµēŌ“µĆµ½ĮĖøüæģµÄ·¢Õ¹”£ Ņ»ÖÖŅŌĮŖ°±(N2H4)ĪŖČ¼ĮĻµÄ»·±£µē³Ų¹¤×÷ŌĄķČēĶ¼ĖłŹ¾£¬¹¤×÷Ź±²śÉśĪȶØĪŽĪŪČ¾µÄĪļÖŹ”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©

A. M¼«Éś³ÉµŖĘųĒŅµē¼«ø½½üpH½µµĶ
B. øŗ¼«ÉĻĆæĻūŗÄ1molN2H4£¬»įÓŠ4molH+ĶعżÖŹ×Ó½»»»Ä¤
C. Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗO2+4H++4e-=2H2O
D. dæŚĮ÷³öµÄŅŗĢåŹĒÕōĮóĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠČČ·½³ĢŹ½ŹéŠ“ÕżČ·µÄŹĒ£Ø £©
A.2SO2+O2=2SO3”÷H=©196.6 kJ/mol
B.2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H=©517.6 kJ/mol
C.H2£Øg£©+ ![]() O2£Øg£©=H2O£Øl£©”÷H=©285.8 kJ
O2£Øg£©=H2O£Øl£©”÷H=©285.8 kJ
D.C£Øs£©+O2£Øg£©=CO2£Øg£©”÷H=+393.5 kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚÖ÷×åŌŖĖŲA£¬B£¬C£¬D£¬E£¬FµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ĖüĆĒµÄŌ×ÓŗĖĶāµē×Ó²ćŹżÖ®ŗĶĪŖ13£®BµÄ»ÆŗĻĪļÖÖĄą·±¶ą£¬ŹżÄæÅÓ“ó£»C£¬DŹĒæÕĘųÖŠŗ¬Įæ×ī¶ąµÄĮ½ÖÖŌŖĖŲ£¬D£¬EĮ½ÖÖŌŖĖŲµÄµ„ÖŹ·“Ó¦æÉŅŌÉś³ÉĮ½ÖÖ²»Ķ¬µÄĄė×Ó»ÆŗĻĪļ£»FĪŖĶ¬ÖÜĘŚŌ×Ó°ė¾¶×īŠ”µÄŌŖĖŲ£®ŹŌ»Ų“šŅŌĻĀĪŹĢā£ŗ
£Ø1£©Š“³öDÓėEŅŌ1£ŗ2µÄŌ×ÓøöŹż±ČŠĪ³ÉµÄ»ÆŗĻĪļµÄµē×ÓŹ½£ŗ £® FµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ £®
£Ø2£©B£¬DŠĪ³ÉµÄ»ÆŗĻĪļBD2ÖŠ“ęŌŚµÄ»Æѧ¼üĪŖ¼ü£ØĢī”°Ąė×Ó”±»ņ”°¹²¼Ū”±£¬ĻĀĶ¬£©£®A£¬C£¬FČżÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļCA4FĪŖ»ÆŗĻĪļ£®
£Ø3£©»ÆŗĻĪļ¼×”¢ŅŅÓÉA£¬B£¬D£¬EÖŠµÄČżÖÖ»ņĖÄÖÖ×é³É£¬ĒŅ¼×”¢ŅŅµÄĖ®ČÜŅŗ¾ł³Ź¼īŠŌ£®Ōņ¼×”¢ŅŅ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £®
£Ø4£©ŌŖĖŲBŗĶFµÄ·Ē½šŹōŠŌĒæČõ£¬BµÄ·Ē½šŹōŠŌÓŚF£ØĢī”°Ēæ”±»ņ”°Čõ”±£©£¬²¢ÓĆ»Æѧ·½³ĢŹ½Ö¤Ć÷ÉĻŹö½įĀŪ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮņĖįŃĒĢśļ§[(NH4)2SO4”¤FeSO4”¤6H2O]Ė׳ĘÄŖ¶ūŃĪ£¬æÉČÜÓŚĖ®£¬ŌŚ100”ꔫ110”ꏱ·Ö½ā”£ŌŚ¶ØĮæ·ÖĪöÖŠ³£ÓĆ×÷±ź¶ØÖŲøõĖį¼Ų”¢øßĆĢĖį¼ŲµČČÜŅŗµÄ±ź×¼ĪļÖŹ£¬»¹ÓĆÓŚŅ±½š”¢µē¶ĘµČ”£
¢ń.»ÆѧæĪĶā»ī¶ÆŠ”×éŃŠ¾æÄŖ¶ūŃĪ¾§ĢåĒæČČŹ±µÄ·Ö½ā²śĪļ”£
(1)¼××éĶ¬Ń§°“ÕÕČēĶ¼ĖłŹ¾µÄ×°ÖĆ½ųŠŠŃŠ¾æ£¬×°ÖĆCÖŠæɹŪ²ģµ½µÄĻÖĻóŹĒ___________£¬ÓÉ“ĖæÉÖŖ·Ö½ā²śĪļÖŠÓŠ_____________”£

(2)ŅŅ×éĶ¬Ń§ČĻĪŖÄŖ¶ūŃĪ¾§Ģå·Ö½āµÄ²śĪļÖŠ»¹ŗ¬ÓŠSO3(g)”¢SO2(g)¼°N2”£ĪŖ½ųŠŠŃéÖ¤£¬Ń”ÓĆ¼××鏵ŃéÖŠµÄ×°ÖĆAŗĶĻĀĶ¼ĖłŹ¾µÄ²æ·Ö×°ÖĆ½ųŠŠŹµŃ锣

¢ŁŅŅ×éĶ¬Ń§µÄŹµŃéÖŠ£¬×°ÖĆŅĄ“ĪĮ¬½ÓµÄŗĻĄķĖ³ŠņĪŖA”¢__________________”£
¢Ś×°ÖĆDÖŠ×ćĮæŃĪĖįµÄ×÷ÓĆŹĒ____________£»ŗ¬ÓŠSO3µÄŹµŃéĻÖĻóŹĒ_______________”£
¢ņ.ĪŖ²āĮņĖįŃĒĢśļ§“æ¶Č£¬³ĘČ”m gÄŖ¶ūŃĪѳʷ£¬Åä³É500mLČÜŅŗ£®¼×”¢ŅŅ”¢±ūČżĪ»Ķ¬Ń§Éč¼ĘĮĖČēĻĀČżøöŹµŃé·½°ø£¬Ēė»Ų“š£ŗ
¼×·½°ø£ŗČ”25.00mLĮņĖįŃĒĢśļ§ČÜŅŗÓĆ0.1000mol”¤L-1µÄĖįŠŌKMnO4ČÜŅŗ·ÖČż“Ī½ųŠŠµĪ¶Ø”£
ŅŅ·½°ø£ŗČ”25.00mLĮņĖįŃĒĢśļ§ČÜŅŗ½ųŠŠČēĻĀŹµŃ锣

±ū·½°ø£ŗ£ØĶعżNH4+²ā¶Ø£©ŹµŃéÉč¼ĘĶ¼ČēĻĀĶ¼ĖłŹ¾£¬Č”25.00mLĮņĖįŃĒĢśļ§ČÜŅŗ½ųŠŠøĆŹµŃ锣

(3)¼×·½°øÖŠµÄĄė×Ó·½³ĢŹ½ĪŖ______________________£¬ČōŹµŃé²Ł×÷¶¼ÕżČ·£¬µ«Ęä²ā¶Ø½į¹ū×ÜŹĒŠ”ÓŚŅŅ·½°ø£¬æÉÄÜŌŅņĪŖ________________£¬ŃéÖ¤ĶĘ²āµÄ·½·ØĪŖ___________________________________ ”£
(4)ŅŅ·½°øÖŠ³ĮµķŹĒ·ńĻ“µÓøɾ»µÄ¼ģŃé·½·ØŹĒ______________________________”£
(5)±ū·½°øÖŠĮæĘų¹ÜÖŠ×ī¼ŃŹŌ¼ĮŹĒ__________________
a.Ė® b.±„ŗĶNaHCO3ČÜŅŗ c.CCl4
(6)Čō²āµĆNH3Ģå»ż£ØŅŃÕŪĖćĪŖ±ź×¼×“æöĻĀ£©ĪŖV L£¬ŌņĮņĖįŃĒĢśļ§“æ¶ČĪŖ_________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŗ¬ÓŠ“óĮæFe2+”¢H+”¢SO42-µÄČÜŅŗÖŠ£¬»¹æÉÄÜ“óĮæ¹²“ęµÄĄė×ÓŹĒ
A. SCN”ŖB. NO3£C. HCO3£D. Ba2+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ2X2(g)+Y2(g)![]() 2Z(g)”÷H=-akJ”¤mol-1(a>0)£¬ŌŚŅ»øöČŻ»ż2LµÄČŻĘ÷ÖŠ¼ÓČė2mol X2ŗĶ1molY2£¬ŌŚ500”ꏱ³ä·Ö·“Ó¦“ļĘ½ŗāŗóZµÄÅضČĪŖ0.8mol”¤L-1£¬·Å³öČČĮæ240kJ”£
2Z(g)”÷H=-akJ”¤mol-1(a>0)£¬ŌŚŅ»øöČŻ»ż2LµÄČŻĘ÷ÖŠ¼ÓČė2mol X2ŗĶ1molY2£¬ŌŚ500”ꏱ³ä·Ö·“Ó¦“ļĘ½ŗāŗóZµÄÅضČĪŖ0.8mol”¤L-1£¬·Å³öČČĮæ240kJ”£
£Ø1£©“Ė·“Ó¦Ę½ŗā³£Źż±ķ“ļŹ½ĪŖ______£»Čō½«ĪĀ¶Č½µµĶµ½300”ę£¬Ōņ·“Ó¦Ę½ŗā³£Źż½«_____£ØĢīŌö“󔢼õÉŁ»ņ²»±ä£©
£Ø2£©Ę½ŗāŹ±Y2µÄ×Ŗ»ÆĀŹĪŖ____________
£Ø3£©ÄÜĖµĆ÷·“Ó¦¼ŗ“ļĘ½ŗāדĢ¬µÄŹĒ___________________________”£
A£®ÅضČc(Z)=2c(Y2) B£®ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä
C£®v£ØX2£©=2 v(Y2) D£®ČŻĘ÷ÄŚµÄĆܶȱ£³Ö²»±ä
£Ø4£©Čō½«ÉĻŹöČŻĘ÷Ģå»żŃ¹Ėõµ½ŌĄ“µÄŅ»°ė£¬ĻąĶ¬ĪĀ¶ČĻĀĘšŹ¼¼ÓČė2molX2ŗĶ1mol Y2“ļµ½Ę½ŗāŗó£¬Y2µÄ×Ŗ»ÆĀŹ½«_________________(Ģī±ä“󔢱䊔»ņ²»±ä)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓÉĻĀĮŠø÷×é²ÄĮĻŗĶµē½āÖŹČÜŅŗÄÜ×é³ÉŌµē³ŲµÄŹĒ
Ń”Ļī | A | B | C | D |
Į½¼«²ÄĮĻ | Mg”¢Mg | Zn”¢Fe | ½šøÕŹÆ”¢Cu | Zn”¢Cu |
µē½āÖŹČÜŅŗ | Ļ”H2SO4 | ŅŅ“¼ | ÅØ H2SO4 | Ļ”ŃĪĖį |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com