
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |

分析 (1)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知,氯苯能使氯化铁生成氯化亚铁,所以氯苯为还原剂;
(2)根据题意氯化铁遇水剧烈水解,仪器B吸收水分,防止氯化亚铁变质;考虑氯化氢极易溶于水;
(3)装置有冷凝回流装置,所以为了提高反应速率,可以将反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失;
(4)①三颈瓶内物质为氯化亚铁、C6H5Cl、C6H4Cl2,根据其溶解性可知;
②可以用有机溶剂将C6H5Cl、C6H4Cl2溶解,过滤后可得氯化亚铁,对滤液进行蒸馏可回收C6H5Cl,据此分析;
(5)根据2FeCl3~HCl~NaOH的关系式计算消耗的FeCl3质量,再计算转化率;
(6)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-),进而计算c(H+),结合溶液稀释前后溶质的物质的量不变计算该题.
解答 解:(1)由装置可知:根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl制备产品,氯苯能使氯化铁生成氯化亚铁,所以氯苯为还原剂;
故答案为:C6H5Cl;
(2)仪器B的为干燥管,作用是防止安全瓶内的水分进入A装置,导致FeCl2变质;氯化氢极易溶于水,防倒吸,选C装置;
故答案为:防止安全瓶内的水分进入A装置,导致FeCl2变质;c;
(3)根据装置图可知,装置有冷凝回流装置,所以为了提高反应速率,可以将反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失;
故答案为:实验使用了冷凝回流装置;
(4)三颈瓶内物质为氯化亚铁、C6H5Cl、C6H4Cl2,根据其溶解性可知,可以用有机溶剂例如苯将C6H5Cl、C6H4Cl2溶解,过滤后可得氯化亚铁,对滤液进行蒸馏可回收C6H5Cl,
①洗涤所用的试剂可以是苯;
故答案为:b;
②回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分;
故答案为:蒸馏滤液,并收集132℃馏分;
(5)2FeCl3~HCl~NaOH,则消耗的n(FeCl3)=2n(NaOH)=2×xy×10-3mol,m(FeCl3)=2×xy×10-3×162.5g,故氯化铁转化率为$\frac{x•y×1{0}^{-3}×2×162.5}{a}×100%$;
故答案为:$\frac{x•y×1{0}^{-3}×2×162.5}{a}×100%$;
(6)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.05mol/L,则加入盐酸的体积至少为$\frac{0.1L×0.05mol/L}{2mol/L}$=2.5mL;
故答案为:2.5.
点评 本题考查实验室制备氯化亚铁的方案设计与评价,题目难度较大,本题注意把握实验操作原理,把握题给信息,掌握实验操作方法,学习中注意积累.


科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
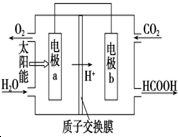 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2都能与水反应生成相应的酸 | |
| B. | 硅可以用做半导体材料,SiO2可用于制光导纤维 | |
| C. | 氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中 | |
| D. | 玻璃是人类最早使用的硅酸盐材料,玻璃加热熔化时有固定的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g D2O含有NA个中子 | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 5.35 g NH4Cl固体中含有N-H键的个数为0.4NA | |
| D. | 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | XZ线上任意点均呈中性,pH=7 | |
| B. | 两条曲线间任意点均有c(H+)•c(OH-)=Kw | |
| C. | M区域内任意点均有c(H+)<c(OH-) | |
| D. | 图中T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
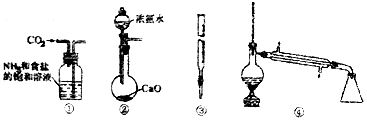
| A. | 装置①可用于模拟侯氏制碱法制取碳酸氢钠 | |
| B. | 装置②可用于制备少量NH3 | |
| C. | 装置③可用于准确取一定体积酸性KMnO4标准溶液 | |
| D. | 装置④常用于分离互不相溶的液体混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com