
【题目】已知气态烃A在标准状况下的密度为1.25 g·L-1,C能够发生银镜反应, E与B、D均能发生酯化反应。有关物质的转化关系如下:

请回答:
(1) F的结构简式______。
(2) A→B的反应类型______。
(3) C→D的化学方程式______。
(4) 下列说法不正确的是______。
A.将金属钠投入B中,金属钠沉入底部,并缓慢的放出气泡
B.2 mol F可以反应产生1 mol环状化合物,其分子式为C4H6O5
C.G加入NaHCO3溶液中会产生气体
D.1 mol H可以与含2 mol NaOH的水溶液完全反应
【答案】![]() 加成反应 CH3CHO+2Cu(OH)2+NaOH
加成反应 CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O BC
CH3COONa+Cu2O↓+3H2O BC
【解析】
本题考查的是有机物的推断。根据密度计算烃A的相对分子质量=1.25×22.4=28,则A为C2H4。A与水在催化剂条件下生成B,B为CH3CH2OH,此反应为加成反应;A与氧气在催化剂条件下生成C,C能与新制的氢氧化铜反应,且能发生银镜反应,说明C为醛,即CH3CHO,A生成C的反应为氧化反应;D为CH3COONa,D经酸化生成E,E为CH3COOH;F与B、E均能发生酯化反应,说明F中含羧基和羟基,则F为HOCH2COOH;B与F生成G,G为HOCH2COOCH2CH3,此反应为酯化反应;E与F生成H,H为CH3COOCH2COOH,此反应为酯化反应。据此解答。
根据密度计算烃A的相对分子质量=1.25×22.4=28,则A为C2H4。A与水在催化剂条件下生成B,B为CH3CH2OH,此反应为加成反应;A与氧气在催化剂条件下生成C,C能与新制的氢氧化铜反应,且能发生银镜反应,说明C为醛,即CH3CHO,A生成C的反应为氧化反应;D为CH3COONa,D经酸化生成E,E为CH3COOH;F与B、E均能发生酯化反应,说明F中含羧基和羟基,则F为HOCH2COOH;B与F生成G,G为HOCH2COOCH2CH3,此反应为酯化反应;E与F生成H,H为CH3COOCH2COOH,此反应为酯化反应;
(1)根据上述分析,F的结构简式为: 。本小题答案为: 。
(2)根据上述分析, A→B的反应类型为加成反应。本小题答案为:加成反应。
(3)C能与新制的氢氧化铜反应,且能发生银镜反应,说明C为醛,生成的D为CH3COONa,则C→D的化学方程式为CH3CHO+2Cu(OH)2+NaOH ![]() CH3COONa+Cu2O↓+3H2O。本小题答案为:CH3CHO+2Cu(OH)2+NaOH
CH3COONa+Cu2O↓+3H2O。本小题答案为:CH3CHO+2Cu(OH)2+NaOH ![]() CH3COONa+Cu2O↓+3H2O。
CH3COONa+Cu2O↓+3H2O。
(4)
A.由上述分析可知B为乙醇,将金属钠投入B中,金属钠的密度大于乙醇密度,金属钠沉底,钠与乙醇反应生成氢气,则会缓慢的放出气泡,故A正确;
B.1mol F可以发生自身的酯化反应,产生1 mol环状化合物,其分子式为C2H2O2,故B错误;
C.G中含有醇羟基和酯基,加入NaHCO3溶液不会反应,不会产生气体,故C错误;
D.H中含有酯基和羧基,可以和氢氧化钠分别发生水解反应和中和反应,1 mol H中含有1mol酯基和1mol羧基可以与2 mol NaOH的水溶液完全反应,故D正确。答案选BC。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示是25℃时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
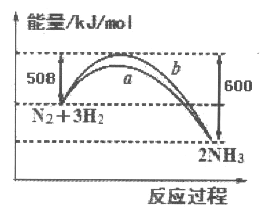
A. 该反应为放热反应
B. b曲线是表示加入了催化剂时的能量变化曲线
C. 加入催化剂,增加了反应的热效应
D. 反应开始通入1 mol N2和3 mol H2,反应后放出的热量一定为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下浓度均为1×10﹣3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④硫酸铵、⑤氨水、⑥氢氧化钠溶液,回答下列问题:
(1)氨水的电离方程式为_______,硫酸铵在水溶液中水解的离子方程式为___________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③________⑥(填“>”、“=”或“<”),溶液中的离子浓度由大到小的顺序为____________________________。
(3)在某温度下(Kw=1×10﹣12),将100 mL的①与100 mL的⑥溶液混合后(假设混合后溶液的体积为混合前两溶液的体积之和),溶液的pH=_________。
(4)若将等体积的②、③溶液加热至相同温度后,溶液的pH ②_______③(填“>” 、“=”或“<”)。
(5)室温时,若用①滴定⑤,适宜的指示剂为_____,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
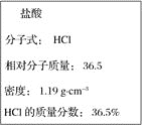
(1)该浓盐酸中HCl的物质的量浓度为_______molL﹣1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl﹣的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”,填C表示“无影响”)。
I.用量筒量取浓盐酸时俯视观察凹液面________;
II.转移浓溶液时操作不慎,有一滴液体溅出容量瓶________;
III.定容摇匀后,发现液面低于刻度线________;
IV.定容时,俯视读数,所得溶液的浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)![]() Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
A. 该反应的化学方程式是2HF![]() (HF)2
(HF)2
B. 平衡时混合气体的平均摩尔质量是33.3
C. t1时刻,保持温度不变,再充入1molM,重新达到平衡时,![]() 将增大
将增大
D. M的沸点比同主族下一周期元素的气态氢化物沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
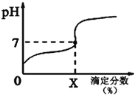
A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减小
B. HA的电离常数KHA=10-7x/(100-x)(x为滴定分数)
C. 当滴定分数为100时,溶液中水的电离程度最大
D. 滴定分数大于100时,溶液中离子浓度关系是c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,请写出相应反应的化学方程式:__________。
(2)装置B中饱和食盐水的作用是___________;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_______________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是_________填字母编号)。
编号 | I | II | III |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是__________________________,该现象__________(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是____________。
(5)装置F的作用是__________________,其烧杯中的溶液不能选用下列中的_____(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 ;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH2,
则ΔH1______ΔH2;(填“> ”、“< ”或“=”)
(2)已知:H2(g)+Cl2(g)===2HCl(g)ΔH=-185 kJ·mol-1,查阅资料可知:H—H键能:436 kJ·mol-1、Cl—Cl键能:243 kJ·mol-1,则H—Cl键能=______________;
(3)在298K、100kPa时,已知:2H2(g)+O2(g)==2H2O(g) ΔH1 ;2HCl(g)==Cl2(g)+H2(g) ΔH2 ;2Cl2(g)+2H2O(g)==4HCl(g)+O2(g)ΔH3 , 则ΔH3与ΔH1和ΔH2的关系是:ΔH3=_______________;
(4)消除氮氧化物的污染对环境至关重要,用CH4催化还原NOx可以消除氮氧化物的污染。已知一定条件下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则该条件下,用CH4还原NO2至N2的热化学方程式为:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com