
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
分析 (1)①Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式;
②Na2SO3稀溶液与碘的四氯化碳溶液不互溶,分层,要使Na2SO3与碘反应,应充分振荡使其接触;
(2)①溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色;
②根据反应方程式,利用关系式法进行计算,Na2S2O3的物质的量是2.0×10-3mol/L×0.01L=2.0×10-5mol,结合I2+2S2O32-═2I-+S4O62-计算I2的物质的量;
③存在KIO3~3I2~6Na2S2O3,以此计算含碘量.
解答 解:(1)①Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式,Na2SO3稀溶液与I2反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+,
故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
②Na2SO3稀溶液与碘的四氯化碳溶液不互溶,分层,要使Na2SO3与碘反应,应充分振荡使其接触.所以在步骤b后,增加操作:将分液漏斗充分振荡后静置,
故答案为:在步骤b后,增加操作:将分液漏斗充分振荡后静置;
(2)①碘遇淀粉变蓝色,所以溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色,说明反应到终点,判断c中反应恰好完全所依据的现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色,
故答案为:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②b中生成的碘在c中反应I2+2S2O32-═2I-+S4O62-,所以
I2 ~2S2O32-,
1mol 2mol
1.0×10-5mol 2.0×10-3mol•L-1×0.0025L×$\frac{100ml}{25ml}$=2.0×10-5mol,
b中反应所产生的I2的物质的量为1.0×10-5mol,
故答案为:1.0×10-5;
③根据(1)中的反应式可知,KIO3~3I2~6Na2S2O3,所以碘酸钾的物质的量是2.0×10-5mol×$\frac{1}{6}$,因此所测精制盐的碘含量是$\frac{2.0×1{0}^{-5}×\frac{1}{6}mol×127g/mol×1000mg}{w×1{0}^{-3}kg}$=$\frac{4.2×1{0}^{2}}{w}$mg/kg,
故答案为:$\frac{4.2×1{0}^{2}}{w}$.
点评 本题考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量,题目难度中等.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇(C2H5OH)和乙烯 | B. | 丙烷和乙醛(CH3CHO) | ||
| C. | 乙烯和乙酸乙酯(CH3COOC2H5) | D. | 甲醛(HCHO)和葡萄糖(C6H12O6) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 |  | 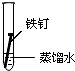 | 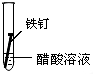 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
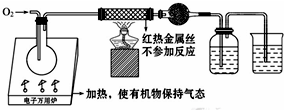 一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: .
.| 物质种类 | 实例(写结构简式) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32-和AlO${\;}_{2}^{-}$ | |
| C. | 用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+ | |
| D. | 取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH${\;}_{4}^{+}$、Al3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
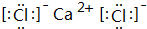 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CHOHCOOH | B. | HO(CH2)2CHO | C. | HOOC-COOH | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
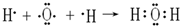
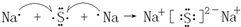 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钾、钠、镁等活泼金属着火时,可用泡沫灭火器灭火 | |
| B. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 | |
| C. | 除去铝粉中混有的铜粉,可先用浓硝酸溶解,然后再过滤、洗涤、干燥 | |
| D. | Ba2+浓度较高时危害健康,BaCO3不能作为造影剂用于X-射线检查肠胃道疾病 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com