
| A. | Na2CO3溶于水 Na2CO3═Na22++CO32- | |
| B. | Al(OH)3酸式电离 Al(OH)3═H++AlO2-+H2O | |
| C. | NaHS溶于水HS-的电离 HS-+H2O?H2S+OH- | |
| D. | NaHCO3在水溶液中电离 NaHCO3═Na++HCO3- |
分析 A.钠离子符号书写错误;
B.氢氧化铝为弱电解质,部分电离用可逆号;
C.硫氢根离子为弱酸的酸式根离子,电离生成硫离子和氢离子;
D.碳酸氢钠为强电解质,完全电离出钠离子和碳酸氢根离子;
解答 解:A.Na2CO3溶于水完全电离,电离方程式:Na2CO3═2Na++CO32-,故A错误;
B.Al(OH)3酸式电离,电离方程式:Al(OH)3 ?H++AlO2-+H2O,故B错误;
C.NaHS溶于水HS-的电离的方程式为:HS-?S2-+H+,故C错误;
D.NaHCO3为强电解质,完全电离出钠离子和碳酸氢根离子,电离方程式:NaHCO3═Na++HCO3-,故D正确;
故选:D.
点评 本题考查了离子方程式书写,侧重考查盐类的水解和电解质的电离,熟悉电解质的强弱、盐类水解规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③ | C. | ②④ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cl2+H2O=HCl+HClO可推出F2+H2O=HF+HFO | |
| B. | HCl的水溶液是强酸,推出HF水溶液也是强酸 | |
| C. | 由2Fe+3Cl2=2FeCl3可推出2Fe+3I2=2FeI3 | |
| D. | Na、K在属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 已知溶液 | 大量存在的离子 |
| A | NH4HCO3溶液 | K+、Na+、NO3-、Cl- |
| B | FeCl3溶液 | Fe2+、NH4+、SCN-、SO42- |
| C | 中性溶液 | Cu2+、K+、Cl-、SO42- |
| D | CH3COOH溶液 | NH4+、Na+、SO42-、CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
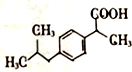
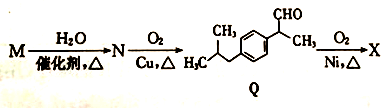
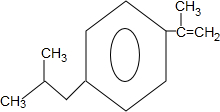 +H2O$→_{△}^{催化剂}$
+H2O$→_{△}^{催化剂}$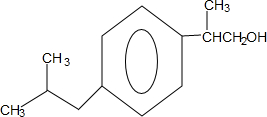 .
. 或
或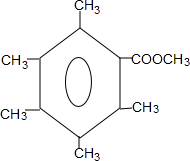 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
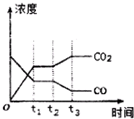 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com