
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
分析 A.海带、海产品中富含碘元素,是获取碘元素的途径;
B.炼铁是将原料(铁矿石、焦炭、石灰石)通入高炉中,在高炉中发生复杂反应,生成铁的单质,生产普通玻璃的原料有砂子,石灰石和纯碱;
C.漂白粉的主要成分为氯化钙、次氯酸钙,是氯气与氢氧化钙反应的产物;
D.金属钠化学性质非常活泼,电解氯化钠溶液无法得到金属钠,必须是电解熔融氯化钠才能得到金属钠.
解答 解:A.海带、海产品中富含碘元素,灼烧溶解,在浸出溶液中加入氧化剂氯水氧化碘离子为碘单质,用有机萃取剂萃取后分液,通过蒸馏得到碘单质,工业上常以海带或其它海产品为原料提取碘,故A正确;
B.炼铁材料为铁矿石、焦炭、石灰石,普通玻璃的原料有砂子,石灰石和纯碱,所以石灰石是炼铁和制玻璃的原料之一,故B正确;
C.氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水,其中氯化钙和次氯酸钙为漂白粉的主要成分,氯气通入石灰乳中制漂白粉,故C正确;
D.钠和水剧烈反应,是活泼金属,电解氯化钠溶液生成氢氧化钠、氯气和氢气,无法得到金属钠,必须通过电解熔融氯化钠获得金属钠和氯气,故D错误;
故选D.
点评 本题考查了金属冶炼的一般原理、工业制碘单质、氯气的化学性质、玻璃和炼铁的主要原料,题目难度中等,注意掌握常见金属的冶炼方法,较活泼的金属,如钠、镁、铝等,通常采用电解方法冶炼.


科目:高中化学 来源: 题型:解答题
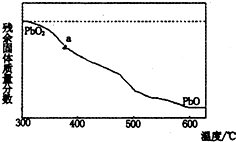 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量NaOH反应,转移的电子数为NA | |
| B. | 常温常压下,11.2 L甲烷中含有的氢原子数小于2 NA | |
| C. | 1 mol碳烯(:CH2)所含的电子数目为6 NA | |
| D. | T℃时,1 L pH=6的纯水中含OH-数为10-6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 向三氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═A1(OH)3↓+3NH4+ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+O2$?_{加热}^{催化剂}$ 2SO 3△H=-196.6 kJ/mol | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O( l )△H=-285.8 kJ/mol | |
| C. | 2H2( g )+O2( g )═2H2O ( l )△H=+571.6 kJ/mol | |
| D. | C(s)+O2( g )═CO2(g)△H=+393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2L N2含有的分子数为0.5 NA | |
| B. | 0.5 NA个氯气分子的物质的量是0.5mol | |
| C. | 标准状况下,18g H2O的体积是22.4L | |
| D. | 0.1 mol•L-1稀硫酸中含硫酸根个数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com