
| A. | 锂盐 | B. | 钠盐 | C. | 钙盐 | D. | 铜盐 |
科目:高中化学 来源: 题型:多选题
| A. | 12g的金刚石晶体中含有碳碳键的数目为4NA | |
| B. | 4g氦气含有的原子总数为NA | |
| C. | 石墨中C和C-C键的比为2:3 | |
| D. | 60gSiO2含有Si-O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
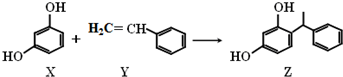
| A. | X、Y和Z均能与溴水发生反应,其中X、Z发生取代反应,Y发生加成反应 | |
| B. | X和Z均能NaOH溶液反应,也能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组 分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
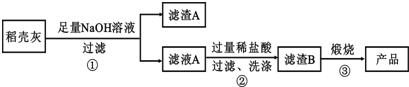
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④⑤ | C. | ④⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ; EB4
; EB4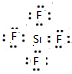 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com