
ij�¶������ݻ�Ϊ 2L ���ܱ������У�������Ӧ 2X(g) + Y(g) 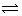 2W(g)����H��0�������� 2 mol X �� 1 mol Y����20 s�ﵽƽ��ʱ������ 0.4 molW������˵����ȷ���ǣ���
2W(g)����H��0�������� 2 mol X �� 1 mol Y����20 s�ﵽƽ��ʱ������ 0.4 molW������˵����ȷ���ǣ���
�������¶ȣ�W �����������С����H ����
���� Y ��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ 0.01 mol/(L·s)
���������������������£����� 1 mol X ���� X �� Y ��ת���ʾ����
������ѹǿ������Ӧ���������淴Ӧ���ʼ�С����ƽ��������Ӧ�����ƶ�
������������ͨ�� 2 mol X �� 1 mol Y���ﵽƽ��ʱ��X��Y ��ת���ʾ�����
A���٢� B���� C���ڢۢ� D���ܢ�
��֪ʶ�㡿��ѧ��Ӧ�����뻯ѧƽ�� G1 G2
���𰸽�����B�����������¶ȣ�W�����������С����ƽ�������ƶ�������H���䣬��Ϊ��H�뷽��ʽ��д���йأ�����ʽȷ������Hȷ�����ٴ��� ��W��Ũ�ȱ仯��ʾ�ķ�Ӧ����v=0.4mol/2L·20s=0.01mol/��L•s����������Y��ʾ�ķ�Ӧ����0.005 mol/��L•s�����ڴ�������X������ƽ�������ƶ�����X��ת���ʻ��С��Y��ת�������۴�������ѹǿ�����淴Ӧ���ʶ��ӿ죬ƽ�������������С�ķ����ƶ�������������Ӧ�����ƶ����ܴ�������������ͨ�� 2 mol X �� 1 mol Y���൱�Ƕ�ԭƽ���ѹ��ƽ�������ƶ����ﵽƽ��ʱ��X��Y ��ת���ʾ�������ȷ��ѡB��
��˼·�㲦��ƽ�ⷢ���ƶ�������˵��Ӧ�ȷ����仯����Ӧ��ֻ�뷽��ʽ��д���йء�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ں��ݾ���(������罻������)�����½���2A(g)��B(g)2C(g)��D(s)��Ӧ��
���±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߡ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ��
_______________________________��
| ���� | A | B | C | D |
| ��ʼͶ��/mol | 2 | 1 | 2 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�鷽�����е���(����)
A��������Һ���Ƿ���SO42��ʱ������BaCl2��Һ���ټ�ϡ���ᣬ�۲�����Ƿ���ʧ
B�����Ҵ���Ũ���Ṳ���Ƶõ�����ͨ������KMnO4��Һ�У������������Ƿ�����ϩ
C��ѡ��25 mL��ʽ�ζ�����ȡ14.80 mL 1 mol·L��1 NaOH��Һ
D��������Һ���Ƿ���CO32��ʱ������ϡ���ᣬ������������ͨ�����ʯ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���б����еĸ�������������������ͼ�����߱�ʾ���ǣ� ��
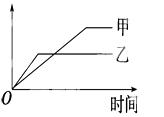
| ��Ӧ | ������ | �� | �� | |
| A | �������ļء��Ʒֱ�������ˮ��Ӧ | H2���� | �� | �� |
| B | ��ͬ����������ͬһ������2NH3 | ������ת���� | 500�� | 400�� |
| C | ������ɱ�ĺ�ѹ�����У������1:3��N2��H2��2NH3 | ������Ũ�� | ���ԸߵĴ��� | ����һ��Ĵ��� |
| D | 2molSO2��1molO2������ͬ�¶���2SO2+O2 | SO3���ʵ��� | 10������ѹ | 2������ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��4 mol����Alȫ��ת��ΪAl��OH��3������HCl a mol��NaOH b mol����a+b����СֵΪ�� ��
A��4 B��6 C��8 D��16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A.�����£�4 gCH4����NA��C-H���ۼ�
B. 1 mol Fe������ϡHNO3��Ӧ��ת��2NA������
C.1 L 0. 1 mol/L NaHCO3��Һ�к���0. 1NA��HCO3-
D.���³�ѹ�£�22.4 LNO2��CO2�Ļ�������к���2NA����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
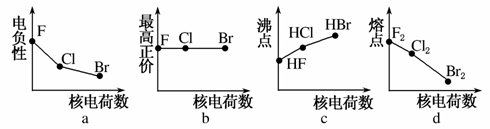
±��Ԫ�ذ���F��Cl��Br�ȡ�
(1)�������߱�ʾ±��Ԫ��ij��������˵�����ı仯���ƣ���ȷ����________��
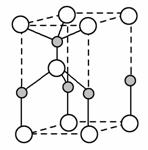
(2)���á�±�����ɺϳɺ�B��N����Ԫ�صĹ����մɣ���ͼΪ�侧���ṹʾ��ͼ����ÿ�������к���Bԭ�ӵĸ���Ϊ________���ù����մɵĻ�ѧʽΪ________��
(3)BCl3��NCl3����ԭ�ӵ��ӻ���ʽ�ֱ�Ϊ________��________����һ�����ܼ���B��N֮��ĵڶ�����Ԫ����________�֡�
(4)��BCl3��XYnͨ��Bԭ����Xԭ�Ӽ����λ������γ����������������ṩ�¶Ե��ӵ�ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ2SO2��O22SO3��һ��ʱ���SO3��Ũ��������0��4 mol��L��1�������ʱ������O2��ʾ�ķ�
Ӧ����Ϊ0��04 mol��L��1��s��1�������ʱ��Ϊ (����)
A��0��1 s B��2��5 s C��5 s D��10 s
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com