
| A | B | C | D |
 |  |  |  |
| 从海水中获得精制食盐 | 用液氨制冷 | 用高粱、小麦酿酒 | 用铝制容器蒸、煮腌制的咸菜 |
| A. | A | B. | B | C. | C | D. | D |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成,据此分析判断.
解答 解:A.食盐精制过程要除去可溶性杂质,除去食盐中的钙离子、镁离子等,要加入碳酸钠、氢氧化钠,发生了化学变化,故A不选;
B.用液氨制冷,是利用液氨挥发带走大量热的特点,是状态的变化,属于物理变化,故B选;
C.用粮食酿酒,是淀粉水解生成葡萄糖,葡萄糖在酒化酶的作用下转化为酒精,有新物质生成,属于化学变化,故C不选;
D.用铝制容器蒸、煮腌制的咸菜,铝在电解质溶液中会发生电化学腐蚀,发生了化学变化,故D不选.
故选B.
点评 本题考查了化学知识在生产生活中的应用,难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.


科目:高中化学 来源: 题型:选择题
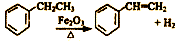 下列说法中错误的是( )
下列说法中错误的是( )| A. | 可用溴的四氯化碳来鉴别乙苯和苯乙烯 | |
| B. | 乙苯分子中所有原子可能都处于同一平面 | |
| C. | 苯乙烯可发生氧化反应、取代反应、加成反应 | |
| D. | 乙苯与苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B可以从溶液中置换出C单质 | |
| B. | 简单离子半径:D>A>B>C | |
| C. | A和D形成的化合物溶于水可导电,所以该化合物为电解质 | |
| D. | 最高价氧化物对应的水化物的酸性:A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80℃时,1L pH=1的硫酸溶液中,含有的OH-数目为10-13NA | |
| B. | 含0.1mol NH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| C. | C3H8分子中的2个H原子分别被1个-NH3和1个-OH取代,1mol此有机物所含共同电子对数目为13NA | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉水解后的溶液中加入碘水,溶液变蓝色,证明淀粉没有水解 | |
| B. | 向NaOH溶液中滴加浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液,出现红褐色沉淀,由此可知Ksp[Fe(OH)3]<Ksp[Al(OH)3] | |
| C. | 向待测试样中加入过量稀盐酸无现象,再滴加BaCl2溶液,有白色沉淀生成,证明试样中含SO42- | |
| D. | 将Fe(NO3)2样品溶于稀硫酸,再滴加KSCN溶液变为红色,证明样品已部分或全部变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z与Q形成化合物的电子式为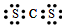 | |
| B. | X与Z、Q形成的化合物均为大气污染物 | |
| C. | Q与W能形成10电子、14电子、18电子分子 | |
| D. | Y、Z、Q分别与X只能组成化学式为AB2型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | Fe3+、K+、I-、SCN | ||
| C. | Al3-、Cu2+、SO42-、NO3- | D. | NH4-、K+、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com