
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同;具有相同的分子式、不同结构的化合物互为同分异构体;
解答 解:B.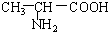 与
与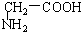 的结构相似,分子间相差若干个CH2原子团,互为同系物;
的结构相似,分子间相差若干个CH2原子团,互为同系物;
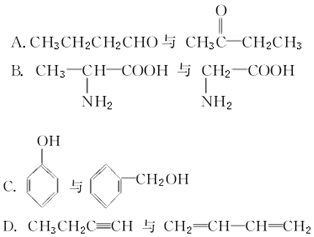
A.CH3CH2CH2CHO与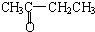 、D.CH3CH2C≡CH与CH2=CH-CH=CH2分子式相同,结构不同,二者互为同分异构体,
、D.CH3CH2C≡CH与CH2=CH-CH=CH2分子式相同,结构不同,二者互为同分异构体,
故答案为:B;AD;
点评 本题考查了同系物、同分异构体的判断、有机物结构与含有官能团类型的关系,题目难度不大,注意掌握常见有机物结构与性质,明确同系物、同分异构体的概念及判断方法,能够根据有机物结构简式判断其含有的官能团类型.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始物质的量(mol) | 3 | 2 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入物质 | HCl(aq) | FeCl3 | NaOH | CH3COONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α4>α2 | B. | α4>α2>α5>α3>α1 | C. | α2>α4>α5>α1>α3 | D. | α1>α3>α5>α2>α4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27.5 g•mol-1 | B. | 55 g•mol-1 | C. | 100 g•mol-1 | D. | 111 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质.
如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质. 查看答案和解析>>
科目:高中化学 来源: 题型:实验题
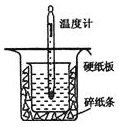 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
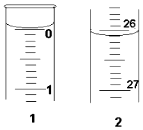 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测氢氧化钠溶 液的体积/mL | 0.1000mol•L+1盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com