
| A. | 粘土 | B. | 石灰石 | C. | 纯碱 | D. | 石英 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | 盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气 | |
| C. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 | |
| D. | 常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
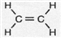
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com