
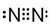 ,(2)H2O2:
,(2)H2O2: ,
, ,(4)CO2:
,(4)CO2: .
. 分析 (1)氮气中存在3对共用电子对,氮原子最外层达到8个电子;
(2)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(3)氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
(4)二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子.
解答 解:(1)氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为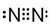 ,故答案为:
,故答案为: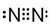 ;
;
(2)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: ;
;
(3)氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,故答案为:
,故答案为: ;
;
(4)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故答案为:
,故答案为: .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及正确的表示方法,明确离子化合物中阴离子需要标出最外层电子,阳离子直接用离子符号表示.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | CO | CuO | H2SO4 | NH3•H2O | Na2S |
| B | CO2 | Na2O | HCl | NaOH | NaCl |
| C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
| D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
| A. | A | B. | B | C. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O | |
| B. | 甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2$\stackrel{△}{→}$HCOOH+Cu2O↓+2H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: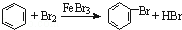 | |
| D. | 将CO2通入苯酚钠溶液: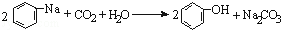 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
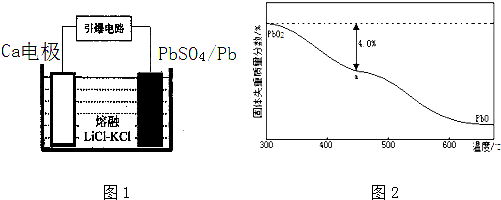
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入甲烷的电极为正极 | |
| B. | 电池工作一段时间后,溶液的碱性增强 | |
| C. | 负极的电极反应:CH4+l0OH--8e-=CO32-+7H2O | |
| D. | 通入甲烷的电极的电极反应:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
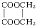 +2H2O,反应类型是酯化反应.
+2H2O,反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Fe粉中混有的I2:加热使I2升华 | |
| B. | 除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶 | |
| C. | 除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶 | |
| D. | 除去氯气中含有的氯化氢气体:用饱和食盐水洗涤后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在1-18号元素中,部分连号元素单质的熔点情况如图所示,试回答:
在1-18号元素中,部分连号元素单质的熔点情况如图所示,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com