
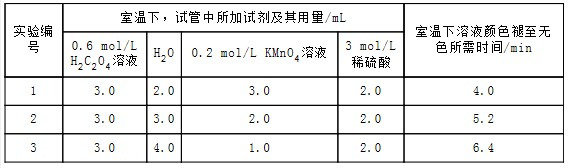
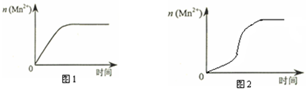
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
分析 (1)从表中数据可知改变的条件是KMnO4浓度,根据高锰酸钾溶液溶液浓度不同对反应速率的影响进行解答;
(2)先根据醋酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率;
(3)①由图乙可知反应开始后锰离子浓度增大,反应速率增加的比较快,所以探究的是硫酸镁在反应中的作用;
②作对比实验时,除了加入MnSO4不同外,其它量完全相同,据此进行解答;
③若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少;
(4)根据在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,阴极上水得电子发生还原反应生成氢气和氢氧根离子,阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子,两电极方程式相加即可得总方程式.
解答 解:(1)从表中数据可知改变的条件是KMnO4浓度;其他条件相同时,增大KMnO4浓度,反应速率增大,
故答案为:其他条件相同时,增大KMnO4浓度反应速率增大;
(2)草酸的物质的量为:0.6mol•L-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol•L-1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:$\frac{0.2mol/L×0.003L}{(3+2+3+2)×1{0}^{-3}L}$=0.06mol/L,
这段时间内平均反应速率v(KMnO4)=$\frac{0.06mol/L}{4min}$=1.5×10-2 mol/(L•min),
故答案为:1.5×10-2 mol/(L•min);
(3)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,
故答案为:MnSO4;
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,
故答案为:与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min);
(4)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为:2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:2MnO42--2e-=2MnO4-,总方程式为:2MnO42-+2H2O=2MnO4-+H2↑+2OH-,
故答案为:MnO42--e-=MnO4-;2MnO42-+2H2O=2MnO4-+H2↑+2OH-.
点评 本题主要结合实验考查了影响化学反应速率的因素、电解原理,题目难度中等,注意掌握温度、催化剂对化学反应速率的影响,明确电解原理及其应用,解题关键是对比分析图表中的数据找出相同点和不同点,然后得出合理结论.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有1mol CuSO4 | |
| B. | 1L水中加入160g CuSO4 | |
| C. | 1mol CuSO4溶于1mol水中 | |
| D. | 将250g CuSO4•5H2O溶于少量水后再稀释成1000mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.30 mol•L -1 | B. | 0.25mol•L -1 | C. | 0.50mol•L -1 | D. | 0.45mol•L -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶粒 | |
| B. | 将80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2 mol/L | |
| C. | 154g CCl4 在标准状况下的体积是22.4L | |
| D. | 在标准状况时,20ml NH3与60ml O2所含分子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
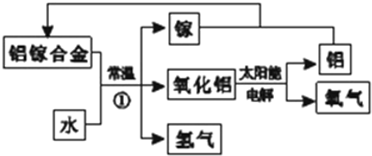 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下:
亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-x+2}{m-n}$ | B. | $\frac{n-(m-x)}{m}$ | C. | $\frac{n(m-x+2)}{m}$ | D. | $\frac{n(m-x+2)}{m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
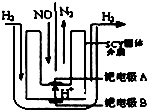 汽车尾气中NOx的消除及无害化处理引起社会广泛关注.
汽车尾气中NOx的消除及无害化处理引起社会广泛关注.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com