
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向Fe(OH)3胶体中加入氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 将NaClO溶液与亚硫酸钠溶液混合:ClO-+SO32-═SO42-+Cl- | |
| D. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- |
分析 A.氨水为弱碱,一水合氨按不能拆开;
B.铁离子能够氧化碘离子;
C.次氯酸根离子能够将亚硫酸氢根离子氧化;
D.镁离子与氢氧根离子反应生成氢氧化镁沉淀.
解答 解:A.向Al2(SO4)3溶液中加入过量氨水,反应生成硫酸铵和氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.向Fe(OH)3胶体中加入氢碘酸溶液,二者发生氧化还原反应,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故B错误;
C.将NaClO溶液与亚硫酸钠溶液混合,反应生成硫酸钠氯化钠,反应的离子方程式为:ClO-+SO32-═SO42-+Cl-,故C正确;
D.反应生成氢气、氯气和氢氧化镁沉淀,正确的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+Mg(OH)2,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:多选题
| A. | AlCl3 | B. | NaHCO3 | C. | Na2CO3 | D. | Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
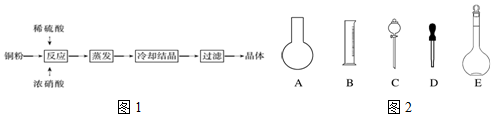
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
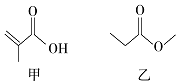
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成反应 | |
| C. | 与甲具有相同官能团的同分异构体还有2种 | |
| D. | 与乙具有相同官能团的同分异构体还有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素与甲、乙、丙形成的二元化合物均只有两种 | |
| B. | 简单离子半径:戊>乙>丙>丁 | |
| C. | 甲、乙、戊三种元素可形成含有共价键的离子化合物 | |
| D. | 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
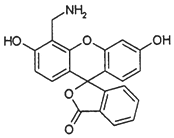
| A. | 分子中三个苯环处于同一平面 | |
| B. | 1 mol 4-AFMF 最多可与2molNaOH 反应 | |
| C. | 在酸性条件下水解,水解产物只有1种 | |
| D. | 能与溴水、FeCl3溶液及稀硫酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度℃ | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液中加入足量的氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 铁片与稀硝酸反应Fe+2H+═Fe2++H2↑ | |
| C. | 氯气通入氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com