
| A. | ①②③④⑤ | B. | ②⑤⑥ | C. | ③④⑤ | D. | ②⑤ |
分析 常见的放热反应有:所有的物质燃烧;所有金属与酸或与水;所有中和反应;绝大多数化合反应;铝热反应;
常见的吸热反应有:绝大数分解反应;个别的化合反应(如C和CO2);工业制水煤气;碳、一氧化碳、氢气还原金属氧化物;某些复分解(如铵盐和强碱).
解答 解:①液态水变成水蒸气吸热,是物理变化,故①错误;
②酸碱中和反应属于放热反应,故②正确;
③浓硫酸稀释放热,是物理变化,故③错误;
④固体NaOH溶于水放热,是物理变化,故④错误;
⑤H2在Cl2中燃烧属于放热反应,故⑤正确;
⑥氯化铵与八水合氢氧化钡反应是吸热反应,故⑥错误;
故选D.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
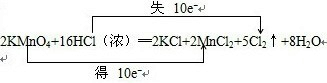 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K | B. | Ba2+、Ca2+、Mg2+ | C. | K+、Ca2+、Cl- | D. | N、O、F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.4gMg和6.5g Zn | B. | Mg和Zn各2.5g | C. | Mg和Al各2.5g | D. | 2.3gNa和2.4gMg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
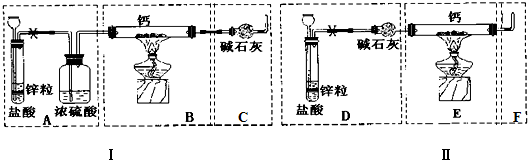
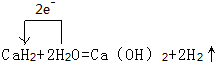 ,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象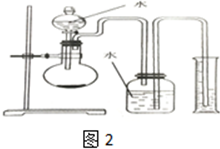
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是还原剂 | B. | C被氧化 | ||
| C. | SiO2发生氧化反应 | D. | O得到电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com