
| A. | 第IA族元素全部是金属元素 | |
| B. | 过渡元素全是金属元素 | |
| C. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 在元素周期表中金属与非金属的分界线附近可以寻找制造半导体的材料 |
分析 A、第IA族元素氢是非金属元素;
B、过渡元素全是金属元素,无非金属元素;
C、第三周期ⅦA族元素为Cl,同周期从左向右非金属性增强;
D、元素周期表的金属与非金属的分界线处的元素具有金属和非金属的性质.
解答 解:A、第IA族元素氢是非金属元素,不全是金属,故A错误;
B、过渡元素全是金属元素,无非金属元素,故B正确;
C、第三周期ⅦA族元素为Cl,同周期从左向右非金属性增强,则Cl是同周期中非金属性最强的元素,故C正确;
D、元素周期表的金属与非金属的分界线处的元素具有金属和非金属的性质,具有半导体性质,故D正确;
故选A.
点评 本题考查元素周期表的结构,为高频考点,侧重元素的位置与原子结构的关系、元素性质变化规律及原子构成的考查,题目难度不大..


科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ①⑦ | C. | ①②⑥ | D. | ①⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
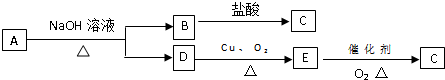
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和二甲醚的分子式相同,结构不同 | |
| B. | 乙醇和二甲醚的物理性质不同,化学性质相同 | |
| C. | 二者完全燃烧后的产物相同 | |
| D. | 1mol二甲醚分子中含有8NA共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:K>Na>Li | B. | 酸性:HClO3>H2SO4>H3PO4 | ||
| C. | 还原性:I->Br->Cl- | D. | 氧化性:F2>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O3和O2互为同位素 | |
| B. | O3与O2的相互转变是物理变化 | |
| C. | 相同状况下,等体积O3和O2含有相同质子数 | |
| D. | O3比O2氧化性更强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | ||||
| Y | Z | W |
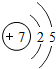 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com