
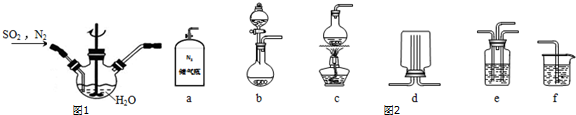
分析 (1)①根据题干,亚硫酸与二氧化锰反应生成硫酸锰和水,增大接触面积,反应速率加快,提高混合其中N2比例,二氧化硫的浓度减小;
②b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止污染空气;
③氧气能与亚硫酸反应生成硫酸;
(2)步骤②为洗涤杂质,防止氧化与溶解损失;
(3)利用MnCO3转化为NiCO3浅绿色固体设计;
(4)pH计测量Na2SO4溶液的pH.
解答 解:(1)①根据题干,亚硫酸与二氧化锰反应生成硫酸锰和水,方程式为H2SO3+MnO2═MnSO4+H2O;MnO2研磨、反应时搅拌均可以增大接触面积,加快反应速率,提高混合其中N2比例,二氧化硫的浓度减小,反应速率减小,
故答案为:H2SO3+MnO2═MnSO4+H2O;AB;
②反应不需要加热制备二氧化硫,b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止尾气中二氧化硫污染空气,
故选:abef;
③制备原理为:H2SO3+MnO2═MnSO4+H2O,若用空气代替N2进行实验,氧气能与亚硫酸反应生成硫酸,二氧化硫利用率降低,
故答案为:空气中的O2能氧化H2SO3,使SO2利用率下降;
(2)步骤②为洗涤杂质,用盐酸酸化的BaCl2溶液检验硫酸根离子是否洗净;MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,应用酒精洗涤,可以防止被氧化,因溶解导致的损失
故答案为:盐酸酸化的BaCl2溶液、乙醇;
(3)向MnCO3固体中滴入NiNO3溶液,白色固体转化为浅绿色固体,说明Ksp(MnCO3)<Ksp(NiCO3),
故答案为:向Na2CO3溶液中滴加0.1 mol•L-1的NiSO4溶液直至浅绿色沉淀不再增加,再滴加少量0.1 mol•L-1的MnSO4溶液,沉淀变成白色;
(4)证明H2SO4的第二步电离不完全,用pH计测量Na2SO4溶液的pH大于7,说明H2SO4的第二步电离不完全,
故答案为:用pH计测量Na2SO4溶液的pH大于7.
点评 本题以物质制备为载体,考查反应速率影响因素、对原理与装置的分析评价、物质的分离提纯、实验方案设计等,注意对题目信息的应用,是对学生综合能力的考查,需要学生具备扎实的基础.


科目:高中化学 来源: 题型:解答题
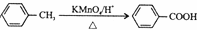
 .
. .
.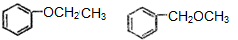 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
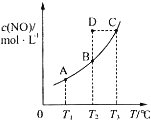 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:| A. | 该反应的Q>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时V正>V逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
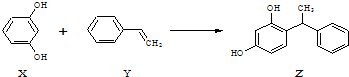
| A. | X、Z均能与Na2CO3溶液反应 | |
| B. | X可作缩聚反应单体,Y可作加聚反应单体 | |
| C. | X、Y、Z均能使溴水褪色,但是原理不相同 | |
| D. | 该反应的反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO3溶液中通入NH3至中性,溶液中存在:c(NH4+)>c(SO32-) | |
| B. | NH4Cl和NH3•H2O混合液pH=7,一定存在c(NH4+)=c(Cl-) | |
| C. | NaHCO3溶液中存在HCO3-+H2O?H3O++CO32-,加水稀释后c(H+)减小 | |
| D. | pH相同的氯化铵与硫酸亚铁铵两种溶液中铵根离子浓度前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 将SO2通入Ba(NO3)2溶液中 | 产生白色沉淀 | BaSO3难溶于水 |
| B | 向试管中加入少量苯,再加入溴水 | 溶液褪色 | 苯可以与Br2发生加成反应 |
| C | 将铝热反应后的固体加入稀硫酸溶解,再加入KSCN | 溶液不变红 | 反应后固体无Fe2O3残余 |
| D | 向盛少量Mg(OH)2固体的试管中加入适量的NH4Cl浓溶液,充分振荡 | 白色固体逐渐溶解 | NH4+与Mg(OH)2电离出的OH-结合导致Mg(OH)2溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com