
 T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:分析 ①W的原子序数为29,其余的均为短周期主族元素,则W是Cu元素;
②T原子所处的周期数、族序数分别与其原子序数相等,则T是H元素;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,则X是C元素;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小,且Q原子序数大于X,所以Q是Na元素;
④Z的基态原子价电子排布为ns2npn+2,且Z原子序数小于Q,Z属于第二周期元素,所以n=2,则Z是O元素,Y是N元素;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子,且原子序数大于Q,则R是Cl元素,据此答题.
解答 解:①W的原子序数为29,其余的均为短周期主族元素,则W是Cu元素;
②T原子所处的周期数、族序数分别与其原子序数相等,则T是H元素;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,则X是C元素;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小,且Q原子序数大于X,所以Q是Na元素;
④Z的基态原子价电子排布为ns2npn+2,且Z原子序数小于Q,Z属于第二周期元素,所以n=2,则Z是O元素,Y是N元素;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子,且原子序数大于Q,则R是Cl元素;
(1)元素的非金属性越强,其电负性越大,由于非金属性N>C>Na,故电负性:N>C>Na,故答案为:N>C>Na;
故答案为:sp3;孤电子对间的排斥力大于孤电子对和成键电子对键的排斥力;
(2)Y的氢化物为氨气,R的氢化物为HCL,氨气分子间易形成氢键,原因是Cl的原子半径比N大,
故答案为:Cl的原子半径比N大;
(3)W为Cu,其基态原子电子排布式为:1s22s22p63s23p63d104s1,则其价层电子排布式为:3d104s1;该元素与元素Y、T能形成的[Cu(NH3)4]2+离子中,含有的化学键为极性键和配位键,则bd正确,
故答案为:3d104s1;bd;
(4)XT2Z的分子式为CH2O,呈平面三角形,则C原子采取sp2杂化;1molM分子中σ键和π键的个数比为3:1,
故答案为:sp2;3:1;
(5)C与N原子结合形成的C3N4晶体,其晶体结构与金刚石类似,说明都是原子晶体,但硬度比金刚石大,是因为氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大,键更稳定,
故答案为:氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大,键更稳定;
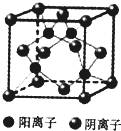
(6)由CuCl的晶胞结构可知,与Cl-离子周围最近的阳离子有4个,构成四面体结构;CuCl晶胞中Cu原子数目为4,Cl原子数目为4个,则晶胞的质量为$\frac{4×99.5g•mo{l}^{-1}}{6.02×1023mo{l}^{-1}}$,晶体的密度为a g•cm-3,则晶胞的体积=$\frac{\frac{4×99.5g•mo{l}^{-1}}{6.02×10{\;}^{23}mo{l}^{-1}}}{ag•c{m}^{-3}}$=$\frac{4×99.5g•mo{l}^{-1}}{ag•cm{\;}^{-3}×6.02×10{\;}^{23}mo{l}^{-1}}$,
故答案为:4;$\frac{4×99.5g•mo{l}^{-1}}{ag•cm{\;}^{-3}×6.02×10{\;}^{23}mo{l}^{-1}}$.
点评 本题考查了物质结构和性质,正确推断元素是解本题关键,明确构造原理、晶体类型的判断、杂化方式的判断、晶胞计算的方法等即可解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随物质变化和能量变化 | |
| B. | 元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强 | |
| C. | 有些放热反应也需要加热才能发生 | |
| D. | 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
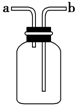
| A. | 洗气装置:瓶内放一定体积溶液,由a管口进气 | |
| B. | 收集不溶于水的气体:瓶内充满水,由b管口进气 | |
| C. | 排空气法收集氧气:由a管口进气 | |
| D. | 排空气法收集氢气:由a管口进气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
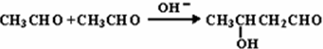
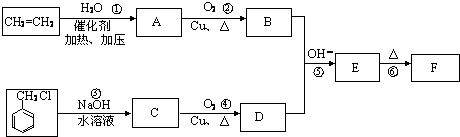
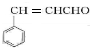 .E中含氧官能团的名称为醛基、羟基.
.E中含氧官能团的名称为醛基、羟基.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消去→加成→水解 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMO4溶液 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉检验方法:加碘化钾变蓝 | B. | 蛋白质检验方法:浓硝酸或燃烧法 | ||
| C. | 蛋白质最终水解产物:葡萄糖 | D. | 淀粉最终水解产物:二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com