
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
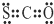
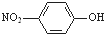
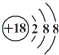

| A. | ①④⑤ | B. | ①②③④⑤ | C. | ③⑤⑥⑦ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
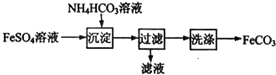
| A. | 过滤操作中所用的玻璃仪器只有烧杯和漏斗 | |
| B. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| C. | 可利用HNO3酸化的BaCl2溶液检验FeSO4溶液中的阴离子 | |
| D. | 沉淀过程中有CO2气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 若反应中转移的电子数可能为$\frac{1}{3}$mol | |
| C. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为7﹕6 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2既是氧化剂也是还原剂 | |
| B. | 被氧化的氯原子数是被还原的氯原子数的5倍 | |
| C. | 当有11.7 g的NaCl生成时,电子转移数为0.2NA | |
| D. | NaCl是还原产物,NaClO3是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
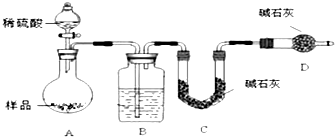
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-4 | Ki=4.9×10-18 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | CN-+H2O+CO2→HCN+HCO3- | |
| B. | 2HCOOH+CO32-→2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com