

| 环境温度/°C | 5 | 10 | 15 | 20 | 25 | 30 | 35 |
| 显色时间/min | 45 | 30 | 15 | 13 | 10 | 7 | 5 |
| 10.02ml+9.98ml |
| 2 |


科目:高中化学 来源: 题型:
 被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )
被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )| A、该有机物的分子式为C14H23O5 |
| B、该有机物不能与NaOH溶液反应 |
| C、该有机物分子中含有过氧键,一定条件下具有氧化性 |
| D、该有机物易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
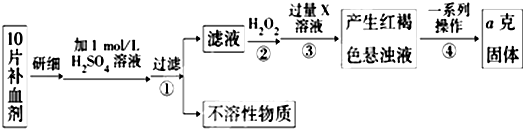
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于0.3 mol |
| B、等于0.15 mol |
| C、小于0.15 mol |
| D、大于0.15 mol,小于0.3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有氨水可以鉴别MgCl2溶液和AlCl3溶液 |
| B、可以用澄清的石灰水鉴别SO2和CO2 |
| C、SO2能使FeCl3、KMnO4水溶液褪色 |
| D、金属钠与CuSO4溶液反应能析出单质Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com