

分析 (1)B装置中氨气与氧气在催化剂存在条件下加热反应生成NO和水,据此判断装置名称并写出反应的化学方程式;
(2)按照气体分子向催化剂表面靠近、被吸附、分子分解成原子、氮原子和氢原子结合生成氨气、氨气分子离开催化剂的顺序解答;
(3)合成氨的反应属于放热反应,热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,NO能被氧气氧化为二氧化氮;
(4)根据NH3制NO的产率是96%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数.
解答 解:(1)B中氨气被催化氧化生成一氧化氮,反应的化学方程式为:4NH3+5O2$\frac{\underline{\;Rt、Rh\;}}{△}$4NO+6H2O,该装置名称为氧化炉(或氧化器),
故答案为:氧化炉(或氧化器);4NH3+5O2$\frac{\underline{\;Rt、Rh\;}}{△}$4NO+6H2O;
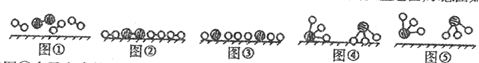
(2)氮气、氢气在催化剂表面合成氨反应过程的顺序为:图①氮气分子和氢气分子向催化剂表面靠近,图②氮气和氢气吸附在催化剂的表面,图③在催化剂的作用下分解成氢原子和氮原子,图④表示氮原子与氢原子重新结合成氨分子,图⑤生成的氨气离开催化剂表面,
故答案为:N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂;
(3)合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
故答案为:利用余热,节约能源;可使NO循环利用,全部转化成HNO3;
(4)由NH3制NO的产率是96%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%=0.96mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.96mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为:$\frac{1mol}{1mol+0.96mol}$×100%=51%;即制HNO3所用去的NH3的质量占总耗NH3质量的51%,
故答案为:51%.
点评 本题以硝酸的工业制备为背景,综合考查对化学反应中化学键变化、转化率计算等考点以及对图形的观察能力、推理能力,题目难度中等,注意掌握工业制取硝酸的反应原理.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:解答题
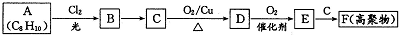
 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
. .
.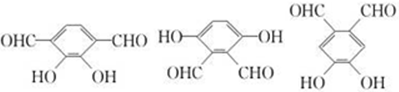 (2种即可).
(2种即可).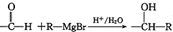 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则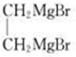 ,
,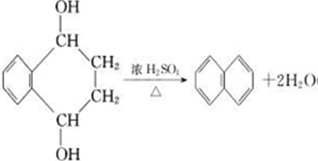 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
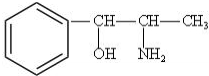 构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知: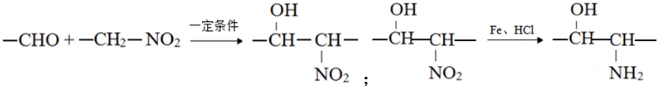
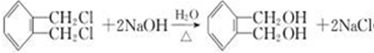
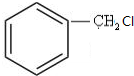 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$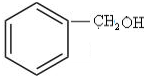 +NaCl.
+NaCl.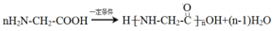 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 常温常压下,14 g由N2和CO组成的混合气体含有的电子总数为7 NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物炼铜比高温炼铜更清洁、成本更低 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| C. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| D. | 扫描隧道显微技术、超分辨率荧光显微技术等技术的发展促进了人类对物质微观结构的探索,使科学研究迈入更高水平层次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答:
有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | N2O5 | D. | NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | b | c | d | |
| 反应前质量(g) | 8 | 10 | 1 | 25 |
| 反应后质量(g) | 未测 | 24 | 2 | 16 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com