
| A. | 在混合物中加入足量浓硫酸,加热、过滤 | |
| B. | 在混合物中加入足量NaOH溶液,过滤 | |
| C. | 用磁石将铁粉吸出 | |
| D. | 在混合物中加入足量浓硝酸,加热、过滤 |
科目:高中化学 来源: 题型:多选题
| A. | 氢化物稳定性C>D>B | |
| B. | BC2与DC2两种气体都能与CaCl2溶液反应产生沉淀 | |
| C. | B、C、D三种元素组成的含氧酸根至少有4种 | |
| D. | Cu单质与A的氧化物、B的氧化物、C单质能生成一种新物质碱式碳酸铜,该反应属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3 | B. | O2 | C. | H2O | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为90 | B. | 中子数为38 | C. | 电子数为52 | D. | 质量数为90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B物质的量浓度 | B. | 混合气体的密度 | ||
| C. | 混合气体的压强 | D. | 混合气体的平均相对分子量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40 g NaOH溶解于1 L水中,得到1 mol•L-1的NaOH溶液 | |
| B. | 将11.2 L HCl气体通入水配成0.5 L的溶液,浓度为1 mol•L-1 | |
| C. | 将1 L 10 mol•L-1的盐酸与9 L水混合,混合液浓度为1 mol•L-1 | |
| D. | 10 g NaOH溶解在水中配成250 mL溶液,其浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
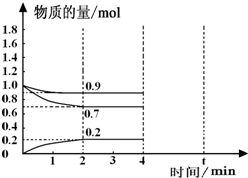 工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com