
 用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.| 5.6L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
 (1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:| 化学键 | H-H | N-H | N≡N |
| 键能kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图Ⅰ为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图Ⅰ为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
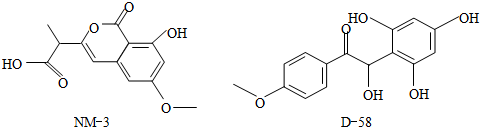
| A、都能与NaOH溶液反应,且等量时消耗的NaOH相同 |
| B、都不能与NaHCO3溶液反应产生CO2 |
| C、都不能发生消去反应,原因完全相同 |
| D、都能与溴水反应,原因完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
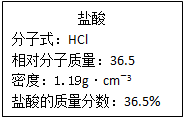 (1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,抽出少量氯气,反应混合液颜色变深 |
| B、加入少量SCl2,平衡向逆反应方向移动 |
| C、单位时间内生成n mol S2Cl2,同时生成2n mol SCl2时,反应达到平衡 |
| D、达平衡时,升高温度,混合液的颜色将变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为防止富脂食品氧化变质可以在包装袋中加入生石灰 |
| B、用医用酒精消毒是因为酒精可以使蛋白质发生盐析 |
| C、绿色食品是不含任何化学物质的食品 |
| D、钠可把钛、锆、铌、钽等金属从它们的熔融的卤化物里还原出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu原子的激发态简化电子排布式为[Ar]3d104s1 |
| B、Fe原子的外围电子排布式为4s2 |
C、丙烷分子的比例模型: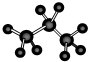 |
D、CH4Si的结构式: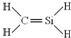 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com