
| 加热 |
| 加热 |
| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
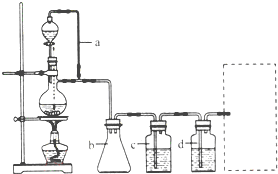 (2011?天津)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
(2011?天津)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:| 一定条件 |
| ||
| Ni,△ |
| ||
| △ |
| 催化剂 |
| 催化剂 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 加热 |
| 加热 |
| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?深圳二模)NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
(2012?深圳二模)NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.| 所加试剂 | 预期现象和结论 |
| 试管A中加足量① 1.0mol/LK淀 粉溶液 1.0mol/LK淀 ;粉溶液 试管B中加1%品红溶液; 试管C中加② 澄清石灰水 澄清石灰水 . |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质; ③ 若A中溶液变蓝色,B中溶液不退色 (无变化),C中溶液不变浑浊(无变化),则 消毒液未变质 若A中溶液变蓝色,B中溶液不退色 则消毒液未变质;(无变化),C中溶液不变浑浊(无变化),则 消毒液未变质 ④ 若A中溶液不变蓝色(无变化),B中溶 液不退色(无变化),C中溶液变浑浊则消 毒液完全变质 若A中溶液不变蓝色(无变化),B中溶 则消毒液完全变质.液不退色(无变化),C中溶液变浑浊则消 毒液完全变质 |
| (2ab-5vc) |
| 50 |
| (2ab-5vc) |
| 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
| △ |
 +NaOH
+NaOH| 乙醇 |
| △ |
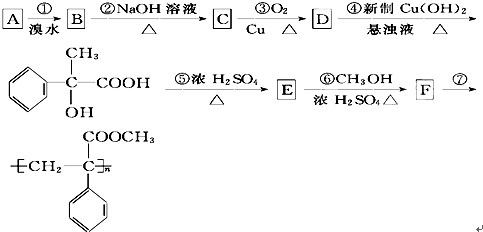






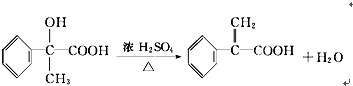

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com