
【题目】(1)已知用含硫酸铁的废液(含少量杂质)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:

回答下列问题:
①试剂X是_______,写出发生的主要反应的离子方程式___________。
②操作Ⅱ的名称为:________、_________。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/LKMnO4溶液滴定,测得消耗KMnO4溶液的平均体积为22.00mL。
滴定终点的现象为: _______________________;该晶体中铁的质量分数为___________。(保留4位有效数字)
(2)某课题组通过实验检验摩尔盐晶体加热时的分解产物。
①摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O b.FeO、NH3、SO3、H2O
c.FeO、SO2、NH3、H2Od.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想___________不成立(填序号)。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有_____________;C装置中红色褪去,说明气体产物中含有__________;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是__________(写一种即可)。

③丙同学想利用上述装置证明分解产物中含有氨气。只需更换B、C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为摩尔盐分解可能会生成N2和SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。

【答案】 Fe 2Fe3++Fe=3Fe2+ 蒸发浓缩 冷却结晶 最后一滴高锰酸钾溶液滴入时,溶液变为浅紫红(红)色,并且30s内不褪色 12.32% a c Fe2O3 SO2 NaOH溶液(或碱石灰等其他合理答案) 碱石灰 酚酞溶液 G、H、I
【解析】⑴①是要用过量的铁将生成的三价铁离子还原为二价,因此X为Fe,主要反应 2Fe3++Fe=3Fe2+;②操作Ⅱ是在溶液中得到FeSO4·7H2O晶体,名称为蒸发浓缩、冷却结晶;③滴定终点时酸性高锰酸钾略过量溶液呈浅红色,现象为:最后一滴高锰酸钾溶液滴入时,溶液变为浅紫红(红)色,并且30s内不褪色;假设25ml铁离子的物质的量为xmol,则
MnO4_ ~ ~ ~ ~ ~ ~ 5Fe2+
1mol 5mol
0.01000mol/L×22.00mL×10-3L/ml x
解之得:x=1.1×10-3mol,则5g样品中铁的物质的量为:1.1×10-2mol,所以样品中铁的质量分数为12.32%;⑵①a.如果分解产物是Fe2O3、SO3、NH3、H2O四种物质,只有Fe的化合价升高,没有化合价降低的元素,是不可能的;c.如果分解产物是FeO、SO2、NH3、H2O四种物质,只有S的化合价降低,没有化合价升高的元素,是不可能的;故答案为:猜想a 、c不成立;②A装置中的固体变为红棕色,则固体产物中含有Fe2O3;C装置中红色褪去,说明气体产物中含有SO2,二氧化硫会污染空气,C装置后应连接尾气吸收装置D,D中盛有的试剂可以是NaOH溶液,故答案为:Fe2O3;SO2;NaOH溶液;③氨气属于碱性气体,则更换后的试剂为B为碱石灰、C为酚酞溶液,若有氨气,则酚酞变红,故答案为:碱石灰;酚酞溶液;④要检验生成SO3(g)及N2,经过安全瓶后通过氯化钡溶液检验SO3,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、H、I,故答案为:G、H、I。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】人工模拟光合作用,设计的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从a极向b极迁移
C. 该转化过程中,水得到电子
D. 该装置中发生的总反应为6CO2+8H2O![]() 2C3H8O+9O2
2C3H8O+9O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按照下图所示的操作程序用于提纯某种物质,下列分析一定正确的是

A. 该操作流程可用于分离水与四氯化碳
B. 操作I-定是过滤,目的是将固液分离
C. 可以用于从四氯化碳中提取碘单质
D. 可以提纯含少量BaSO4的NaCI固体混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是

A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屈昔多巴( ![]() )是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线(
)是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线( ![]() 简写为BnCl,
简写为BnCl, ![]() 简写为CbzCl ):
简写为CbzCl ):

回答下列问题:
(1)反应①的反应类型为_________,其作用为_____________。
(2)屈昔多巴中所含的非含氧官能团名称为_______________,屈昔多巴分子中有_____个手性碳原子。
(3)反应②为加成反应,则有机物X的名称为________________。
(4)![]() 显________性(填“酸”、“中”或“碱”)。
显________性(填“酸”、“中”或“碱”)。
(5)![]() 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
(6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线: __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
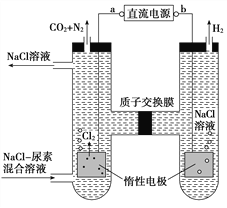
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
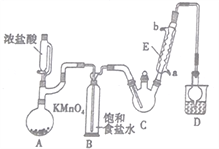
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是____________,冷凝水的流向是________进_______出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________,引起的后果是_________________。
(3)仪器A中发生反应的离子方程式为____________________。
(4)该装置C可采用_______________,加热的方法以控制反应温度在70℃左右。
(5)装置D干燥管的作用为_______________,装置D烧杯中的试剂是_______________。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________(填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前国际空间站处理CO2废气涉及的反应为CO2+4H2![]() CH4+2H2O。该反应的下列说法正确的是
CH4+2H2O。该反应的下列说法正确的是
A. 通过使用钌催化剂能使CO2 100%转化为CH4
B. 该温度下,当反应达平衡时,CH4物质的量就不再变化,因为反应已停止不再进行
C. 除了使用催化剂,升高温度或增大压强都能加快该反应的速率
D. 由于升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com