
| A、降低温度 |
| B、增大压强 |
| C、使用催化剂 |
| D、减小SO2的浓度 |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、含0.1mol BaCl2的溶液中Cl-数为0.2NA |
| B、22g CO2所含有的分子数为0.5NA 已知M(CO2)=44g/mol |
| C、11.2L CO2所含有的分子数为0.5NA |
| D、常温下NA个N2分子电子数为14NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ |
| C、①④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氯气和消石灰制漂白粉 |
| B、用纯碱、石灰石和石英制普通玻璃 |
| C、用石油炼制过程脱硫得到的硫磺制造硫酸 |
| D、用金属钠从四氯化钛(TiCl4)中提炼金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol/L |
| B、0.25mol/L |
| C、5mol/L |
| D、1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下,1L 0.1mol?L-1的NH4NO3溶液中NH
| ||
| B、常温下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA | ||
| C、标准状况下,2.24L乙烷中含有的非极性键数为0.7NA | ||
| D、1molCl2与足量的氢氧化钠溶液反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应不一定都有反应热 |
| B、使用催化剂可以改变反应的平衡常数 |
| C、升高温度使反应加快,是因为降低了反应的活化能 |
| D、对于同一个化学反应无论是一步完成还是分几步完成,其反应的焓变相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
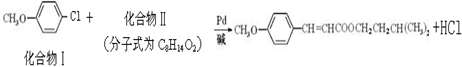

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com