
【题目】一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g) ![]() Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
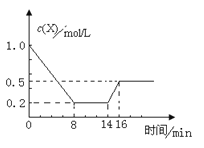
A.0~8min用Y表示该反应速率为0.1mol·L-1·min-1
B.8min时达到平衡,该反应的平衡常数为K= 0.5
C.14min时,改变的反应条是降低了温度
D.16min时的正反应速率比8min时的正反应速率大
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 化学反应的反应热与反应过程有密切的关系
B. 化学反应的反应热取决于反应体系的始态和终态
C. 盖斯定律只是一条简单的自然规律,其实际作用不大
D. 有的化学反应过程没有能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 浓H2SO4具有氧化性,可用作SO2的干燥剂
B. H2O2能使蛋白所变性,可用作医疗的消毒剂
C. C2H4气体具有可燃性,可用作果实的催熟剂
D. Fe2O3水溶液显弱酸性,可用作H2S的脱除剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )

A. X与M形成的一个阴离子中含有29个电子
B. 气态氢化物沸点Y>R
C. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z单质能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A. 5:2 B. 3:1 C.15:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,C与A同主族;A与B、D、E所形成的常见化合物在常温下均呈气态,在周期表中D与E左右相邻,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数与E的最外层电子数相同。
请回答下列问题:
(1)B在元素周期表的位置为第_____周期,第_____族。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序为______(用离子符号表示)。
(3)A、B、E可组成一种化合物,其原子个数之比为4:1:1,该化合物的水溶液与C的最高价氧化物的水化物反应的离子方程式为____________________________________;
(4)B的一种氢化物分子中含有18个电子,其结构式为____________;C与D同主族短周期元素原子形成个数比为1:1的化合物,用电子式表示其化学键的形成过程为________________________。
(5)BE3在常温下是一种淡黄色的液体,遇水即发生水解可生成一种具有漂白性的物质和一种核外电子总数为10的气体,写出该反应的化学方程式___________________________;
(6)下列事实能证明D与E非金属性强弱的是_____________________(选填字母序号)。
A.常温下,D的单质呈固态,E的单质呈气态
B.E的氢化物的稳定性强于D的氢化物
C.E与D形成的化合物中,D呈正价
D.E的氢化物的沸点高于D的氢化物
(7)已知D、E两种元素形成的化合物H,H结构与过氧化氢相似,属于______________(填“离子”或“共价”)化合物。5.4 g的H中含有的共用电子对数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,则:
①A和B周期数之差为________
②A和B的质子数之差为___________(用m、n表示)
③B和A的族序数之差为_______________(用含m、n的代数式表示)
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。
如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为______________;
当B在A的下一周期时,B的原子序数为______________;
如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为______________;
当B在A的下一周期时,B的原子序数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去括号内杂质的有关操作方法不正确的是( )
A. 淀粉溶液(葡萄糖):渗析
B. 乙醇(乙酸):加KOH溶液,分液
C. 甲醛溶液(甲酸):加NaOH溶液,蒸馏
D. 肥皂液(甘油):加食盐搅拌、盐析、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为_____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式为____________________。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4
上述反应热效应之间的关系式为△H4=_______________(用△H1、△H2、△H3表示)。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为
(已知:N2H4 + H+ ![]() N2H5+ K=8.5×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+ K=8.5×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com