
下列指定反应的离子方程式正确的是()
A. Cu溶于稀硝酸:Cu+2H++NO3﹣→Cu2++NO2↑+H2O
B. 在复盐NH4Fe(SO4)2溶液中逐滴加入一定量的Ba(OH)2溶液:2Fe3++3SO42﹣+3Ba2++6OH﹣→3BaSO4↓+2Fe(OH)3↓
C. 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH﹣+CO32﹣+4H+→CO2↑+3H2O
D. 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2﹣+2H2O=Al(OH)3↓+HCO3﹣
考点: 离子方程式的书写.
专题: 离子反应专题.
分析: A.反应生成NO,电子、电荷不守恒;
B.逐滴加入Ba(OH)2溶液,碱完全反应;
C.加入稀盐酸,少量时,只发生酸碱中和,过量时生成二氧化碳,但等物质的量时,OH﹣与CO32﹣的物质的量相同;
D.向NaAlO2溶液中通入过量CO2生成氢氧化铝和碳酸氢钠.
解答: 解:A.Cu溶于稀硝酸的离子反应为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,故A错误;
B.在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应离子方程式是NH4++Fe3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Fe(OH)3↓+NH3•H2O,故B错误;
C.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸生成气体时的离子反应为2OH﹣+2CO32﹣+6H+=CO2↑+4H2O,故C错误;
D.向NaAlO2溶液中通入过量CO2制Al(OH)3的离子反应为CO2+AlO2﹣+2H2O=Al(OH)3↓+HCO3﹣,故D正确.
故选D.
点评: 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子方程式的书写方法为解答的关键,侧重氧化后还原反应、与量有关的离子反应考查,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
过氧化钠与CO2作用,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2.当0.2mol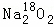 与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是( )
与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是( )
选项 Na2CO3的质量 关于O2的描述
A 21.2g O2的摩尔质量是36g•mol﹣1
B 21.6g 生成标准状况下O2的体积为2.24L
C 21.6g O2的摩尔质量是34g•mol﹣1
D 22.4g 生成标准状况下O2的体积
为2.24mL
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
有三支试管,分别加入下列物质后甲:10mL 0.01mol/L FeCl3溶液和10mL 0.01mol/L KSCN溶液乙:5mL水、10mL 0.01mol/L FeCl3溶液5mL 0.01mol/L KSCN溶液丙:10mL 0.1mol/L FeCl3溶液和10mL 0.1mol/L KSCN溶液观察这三支试管的颜色,其中颜色最浅的是()
A. 甲试管 B. 乙试管 C. 丙试管 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是()
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤②不通氨,冷却、加食盐,过滤对上述两种方法评价中错误的是()
A. ①析出的氯化铵纯度更高 B. ①的滤液可直接循环使用
C. ②析出的氯化铵纯度不高 D. ②的滤液可直接循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL 于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4﹣同时被还原为Mn2+.向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+.
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL.
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、冷却、转移、洗涤并转移、 、摇匀.
(2)加入锌粉的目的是 .
(3)写出步骤三中发生反应的离子方程式 .
(4)实验测得该晶体中铁的质量分数为 .在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.
(5)请纠正上述实验过程中的两处错误: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是强电解质或弱电解质的是( )
|
| A. | 某物质熔化时不导电,则该物质为弱电解质 |
|
| B. | 某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
|
| C. | 某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
|
| D. | 溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体摩尔体积的描述中正确的是( )
-A.-相同条件下,气体物质的量越大,气体摩尔体积越大
-B.-通常状况下的气体摩尔体积大于22.4L/mol
-C.-非标准状况下的气体摩尔体积不可能为22.4L/mol
-D.-在标准状况下,混合气体的气体摩尔体积比22.4L/mol大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl﹣物质的量浓度相等的是( )
|
| A. | 150mL 2mol/L KCl溶液 | B. | 75mL 1.5mol/L MgCl2溶液 |
|
| C. | 100mL 1mol/L NaCl溶液 | D. | 25mL 2mol/L AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com