
| A. | 中子数是6 | B. | 质量数是14 | C. | 电子数是14 | D. | 中子数是14 |
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:实验题
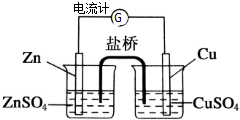 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
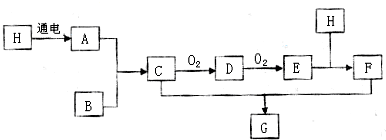
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 纯净物与混合物属于包含关系 | B. | 化合物与酸性氧化物属于包含关系 | ||
| C. | 单质与化合物属于交叉关系 | D. | 分散系与胶体属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 0.5mol Na2SO4中含Na+数目为6.02×1023个 | |
| C. | 标准状况下,1molH2O体积约为22.4L | |
| D. | 1molO2的质量为32g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨因为有刺激性气味,因此不用来做制冷剂 | |
| B. | 浓硫酸稀释是往浓硫酸中慢慢倒入水,并用玻璃棒不断的搅拌 | |
| C. | 元素周期表中,族序数都等于该元素原子的最外层电子数 | |
| D. | 往水玻璃中通入CO2:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ 可证明碳酸的酸性强于硅酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 100 mL 0.1 mol•L-1 Na2SO4溶液中,粒子总数是0.03NA | |
| C. | 标准状况下,33.6 LHF中含有氟原子的数目为1.5NA | |
| D. | 常温常压下,7.0 gC2H4与C3H6的混合物中含有氢原子的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com