
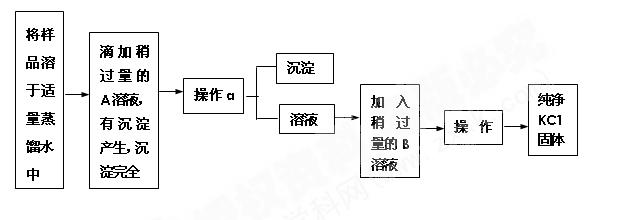
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 +4)制取纳米级TiO2的流程如下:
+4)制取纳米级TiO2的流程如下: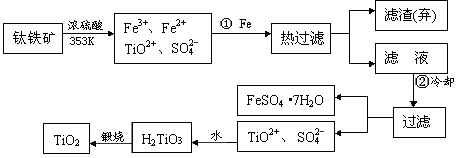
 TiCl4
TiCl4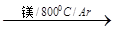 Ti
Ti 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
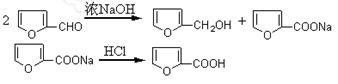
查看答案和解析>>
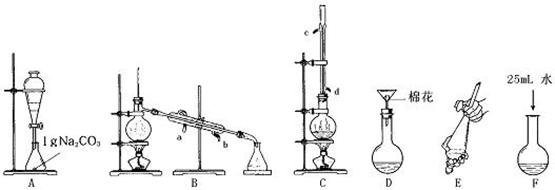
科目:高中化学 来源:不详 题型:实验题
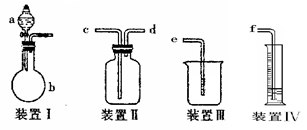
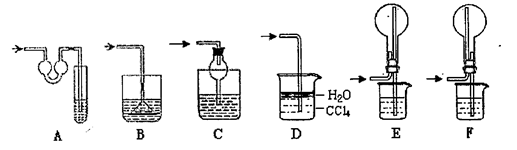
装 置序号 置序号 | 仪器中所加物质名称 | 目的或现象 |
| | | |
| | | |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
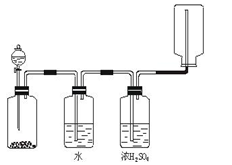
| A.锌和盐酸生成氢气 |
| B.亚硫酸钠和浓硫酸生成二氧化硫 |
| C.碳酸钙和盐酸生成二氧化碳 |
| D.氯化钠和浓硫酸生成氯化氢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
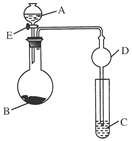
查看答案和解析>>
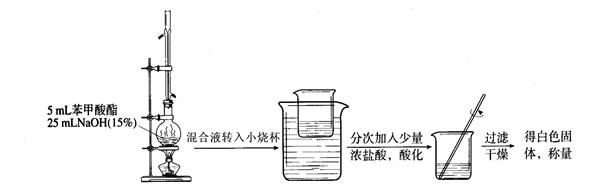
科目:高中化学 来源:不详 题型:实验题
| | 苯甲酸 | 甲醇 | 苯甲酸甲酯 |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
|
 G H I
G H I查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com